
Белки. Часть 1: химия белков

Наталья Трунилина
Белки. Часть 1: химия белков
Часть первая.
I. Определение и биологическая роль белков.
БЕЛКИ – высокомолекулярные биополимеры, состоящие из аминокислот, соединённых в определённой последовательности и имеющие структурную организацию.
Биологическая роль белков.
СТРУКТУРНАЯ
КАТАЛИТИЧЕСКАЯ (ферменты)
РЕГУЛЯТОРНАЯ (гормоны)
ДЫХАТЕЛЬНАЯ (Hb-гемоглобин)
ТРАНСПОРТНАЯ (альбумины и др.)
ЗАЩИТНАЯ (Jg-иммуноглобулины или антитела)
СОКРАТИТЕЛЬНАЯ (белки мышц)
ОПОРНО-ДВИГАТЕЛЬНАЯ (коллаген) и др. функции
и только в последнюю очередь энергетическая
II. Аминокислоты.
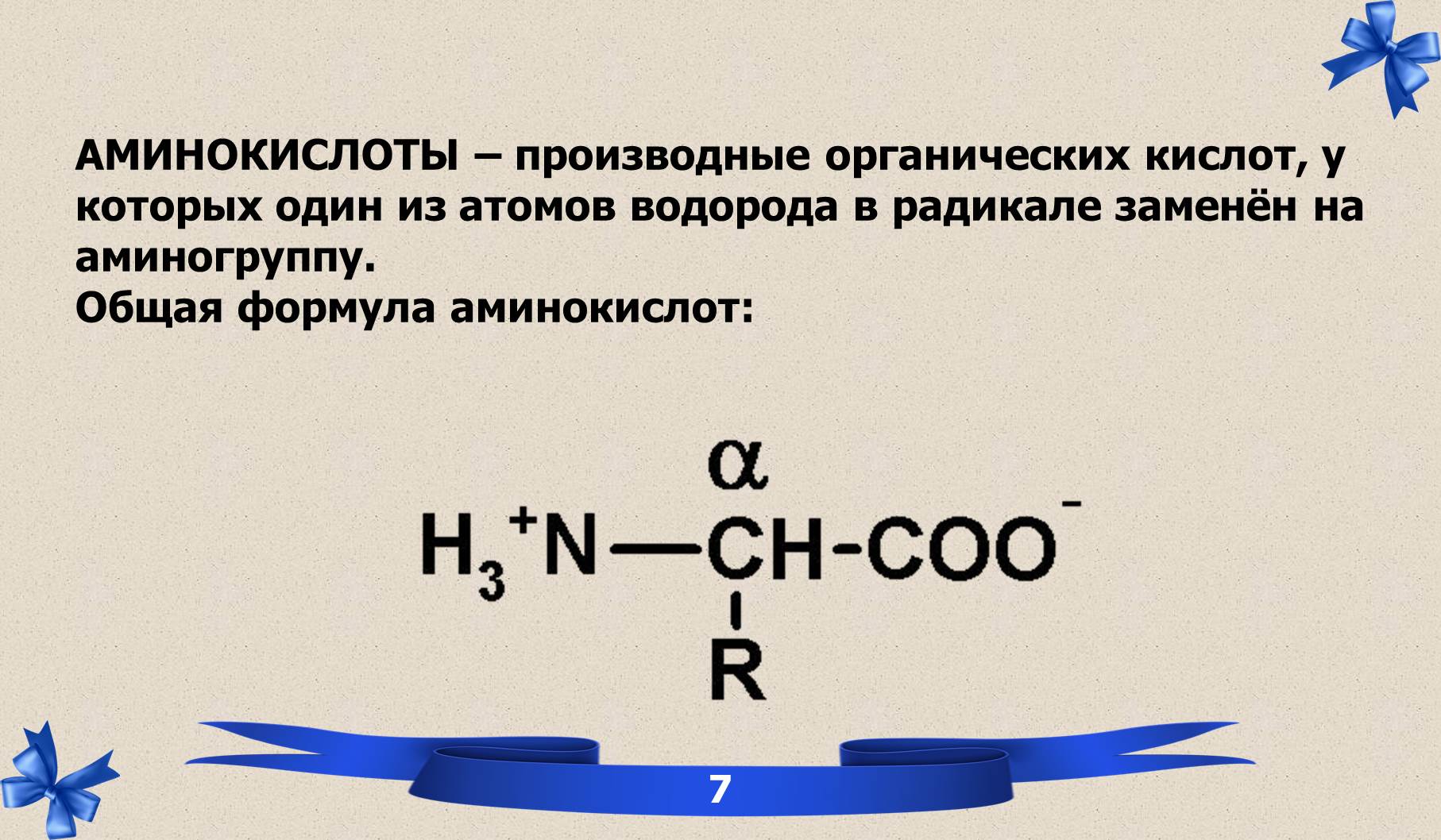
2.1 Гомологический ряд одноосновных и двухосновных органических кислот.

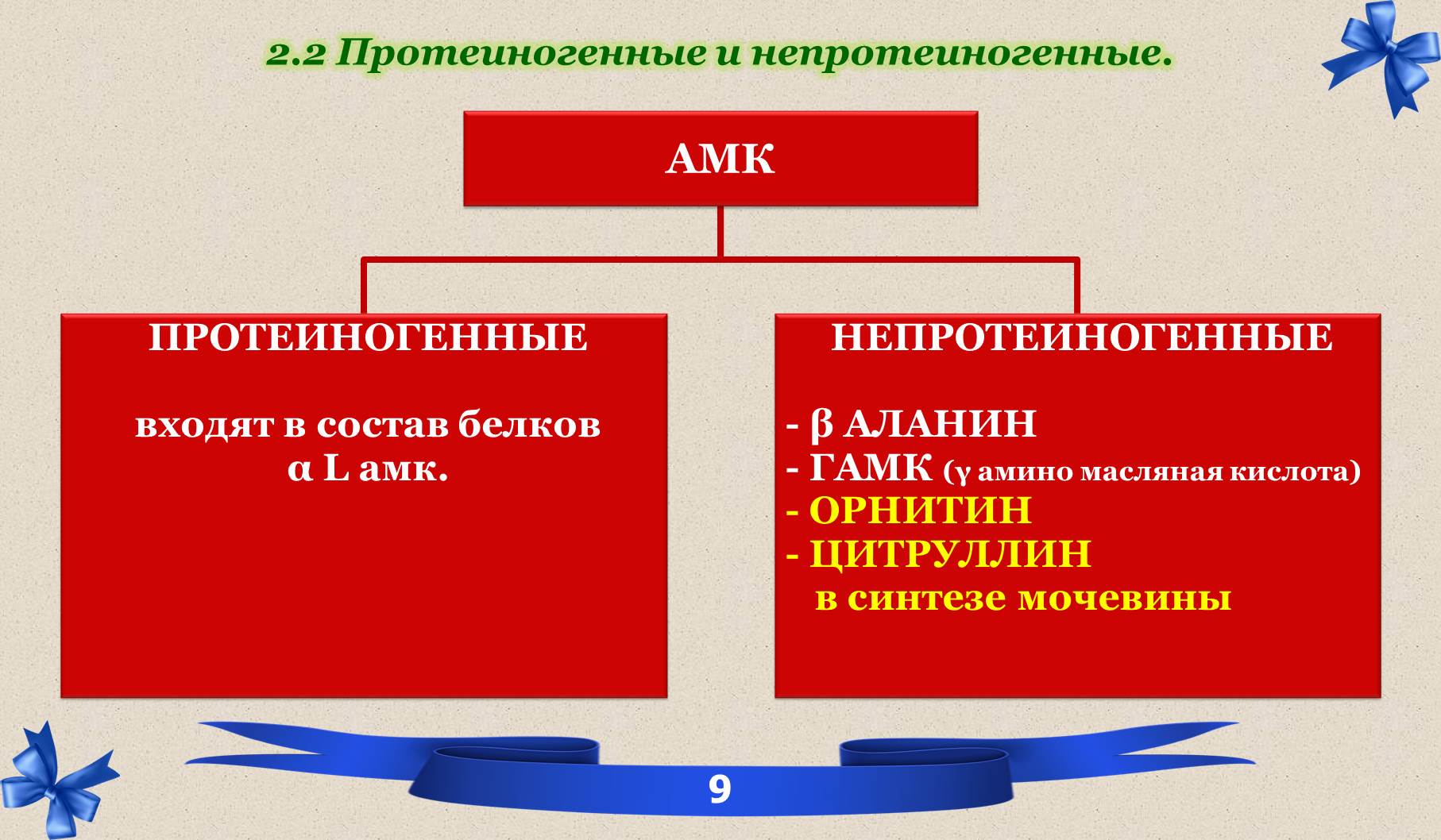
2.2 Протеиногенные и непротеиногенные.
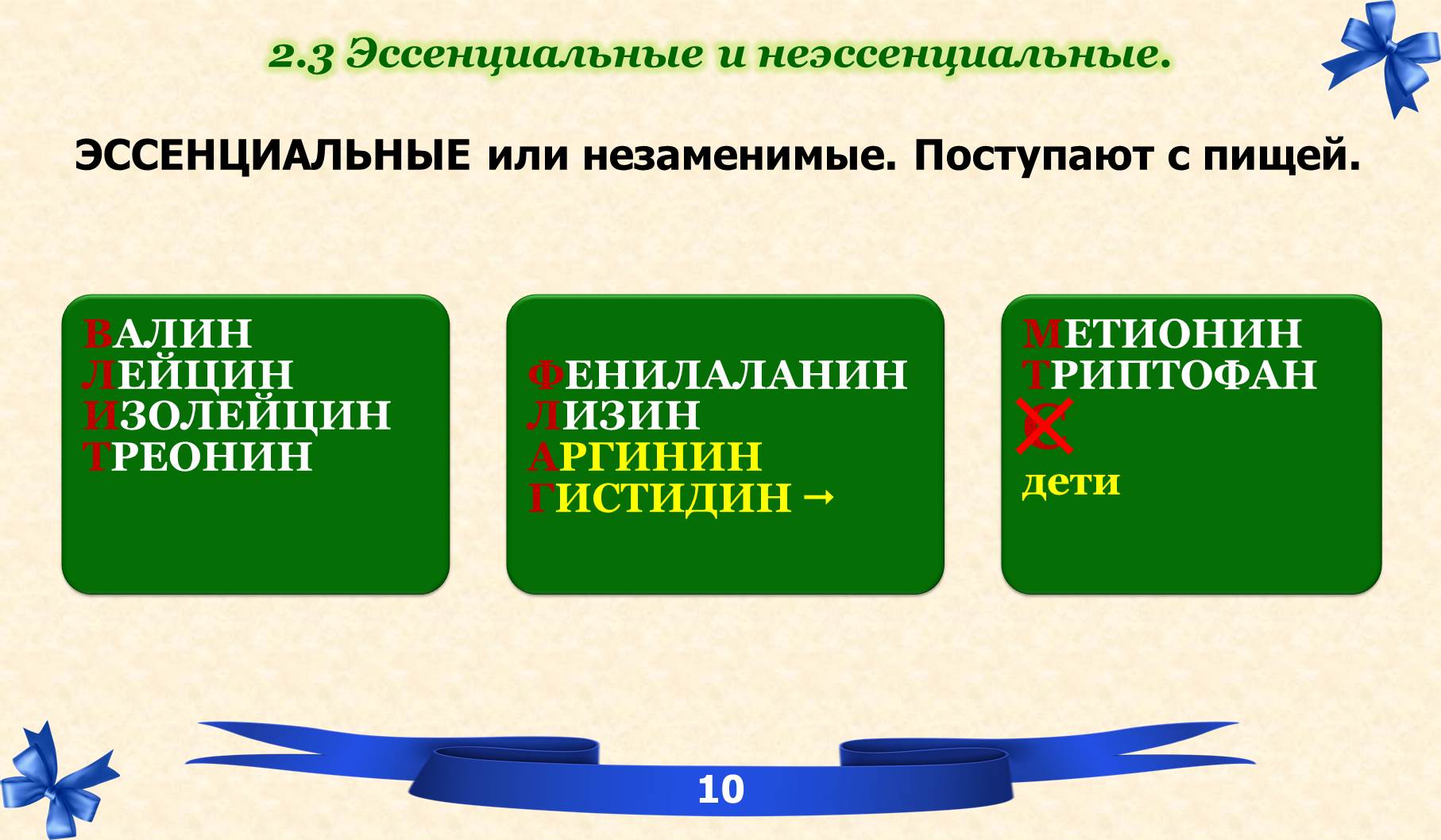
2.3 Эссенциальные и неэссенциальные.
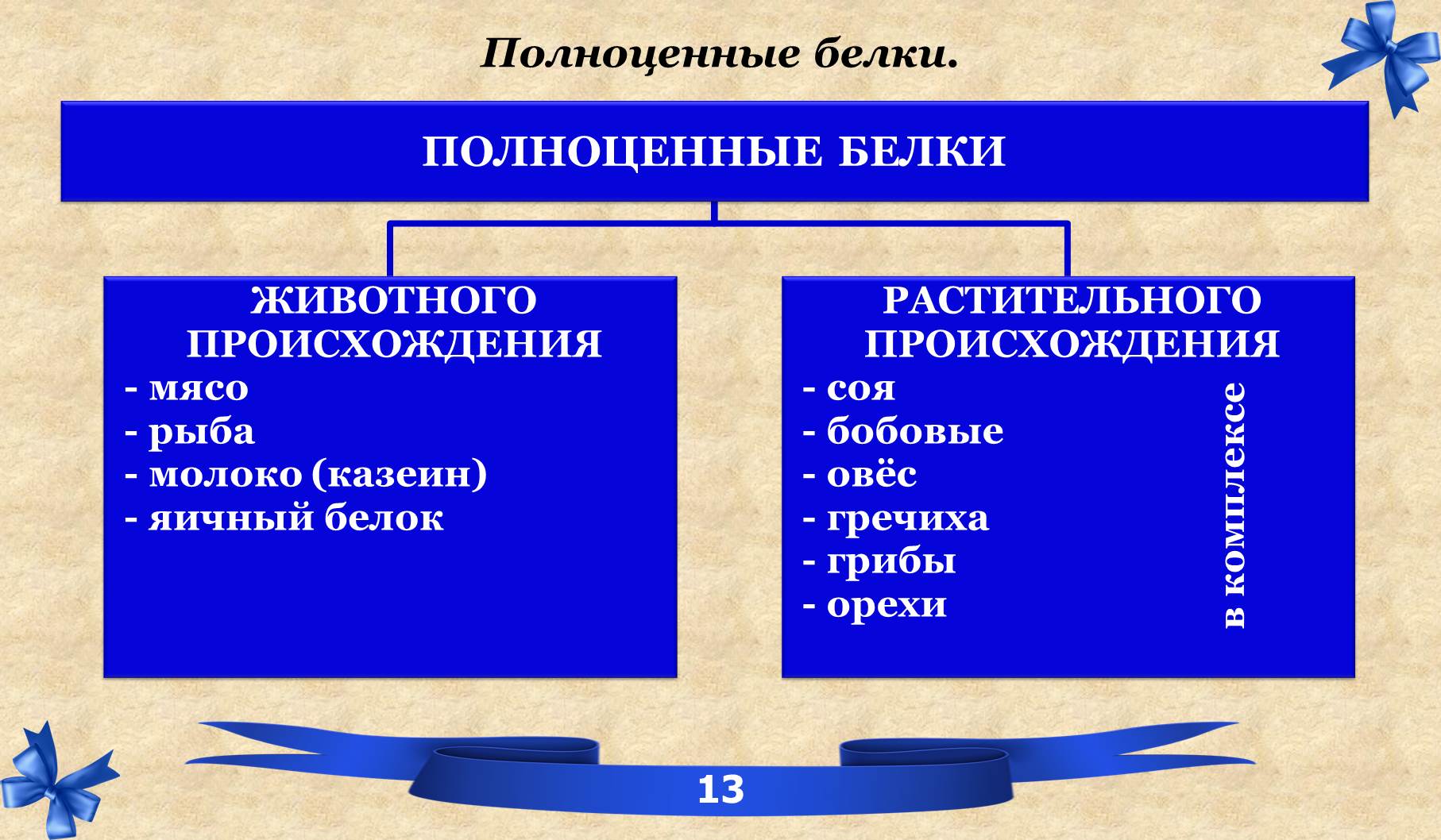
2.4 Белки. Полноценные и не полноценные.


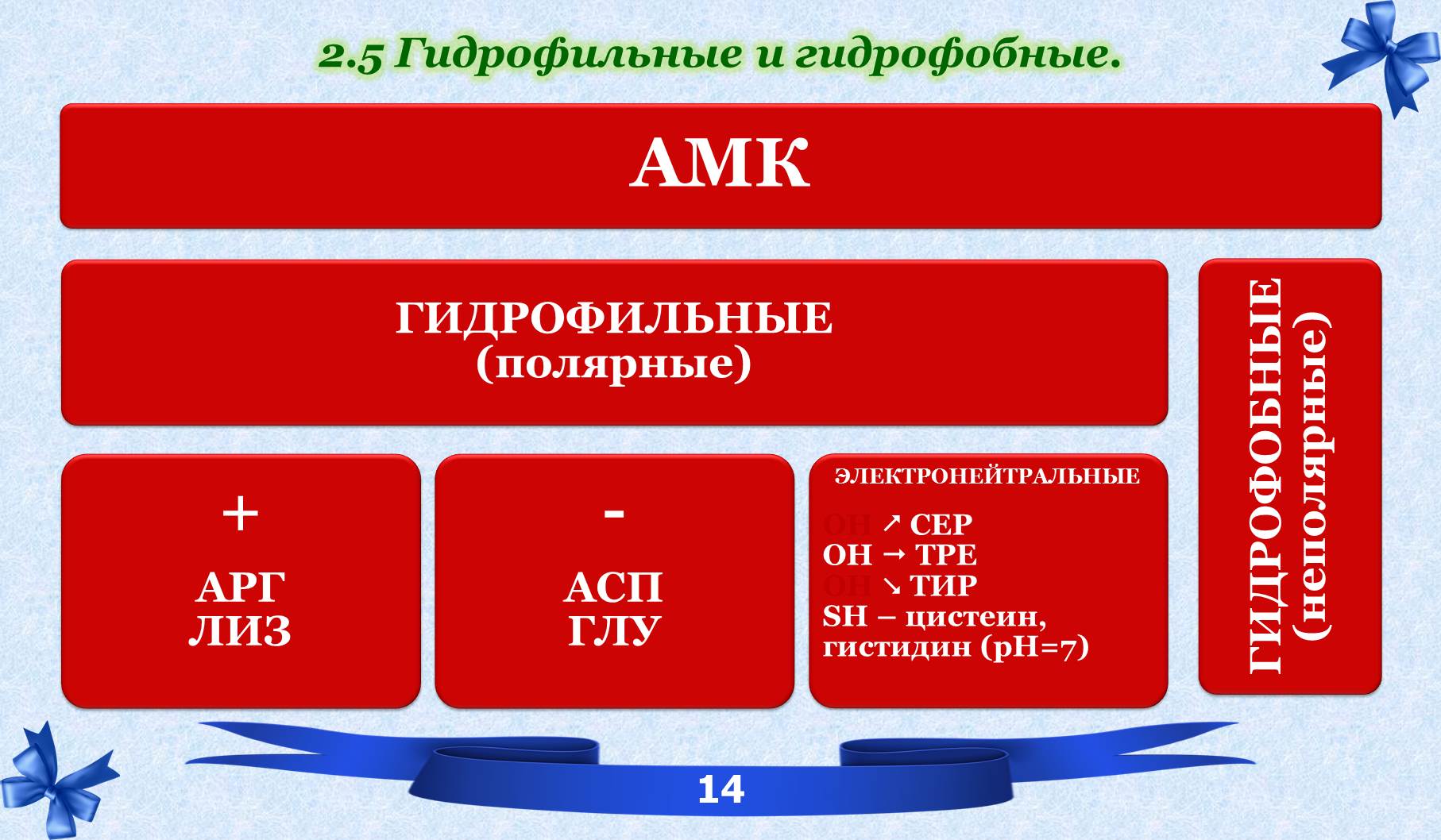
2.5 Гидрофильные и гидрофобные.
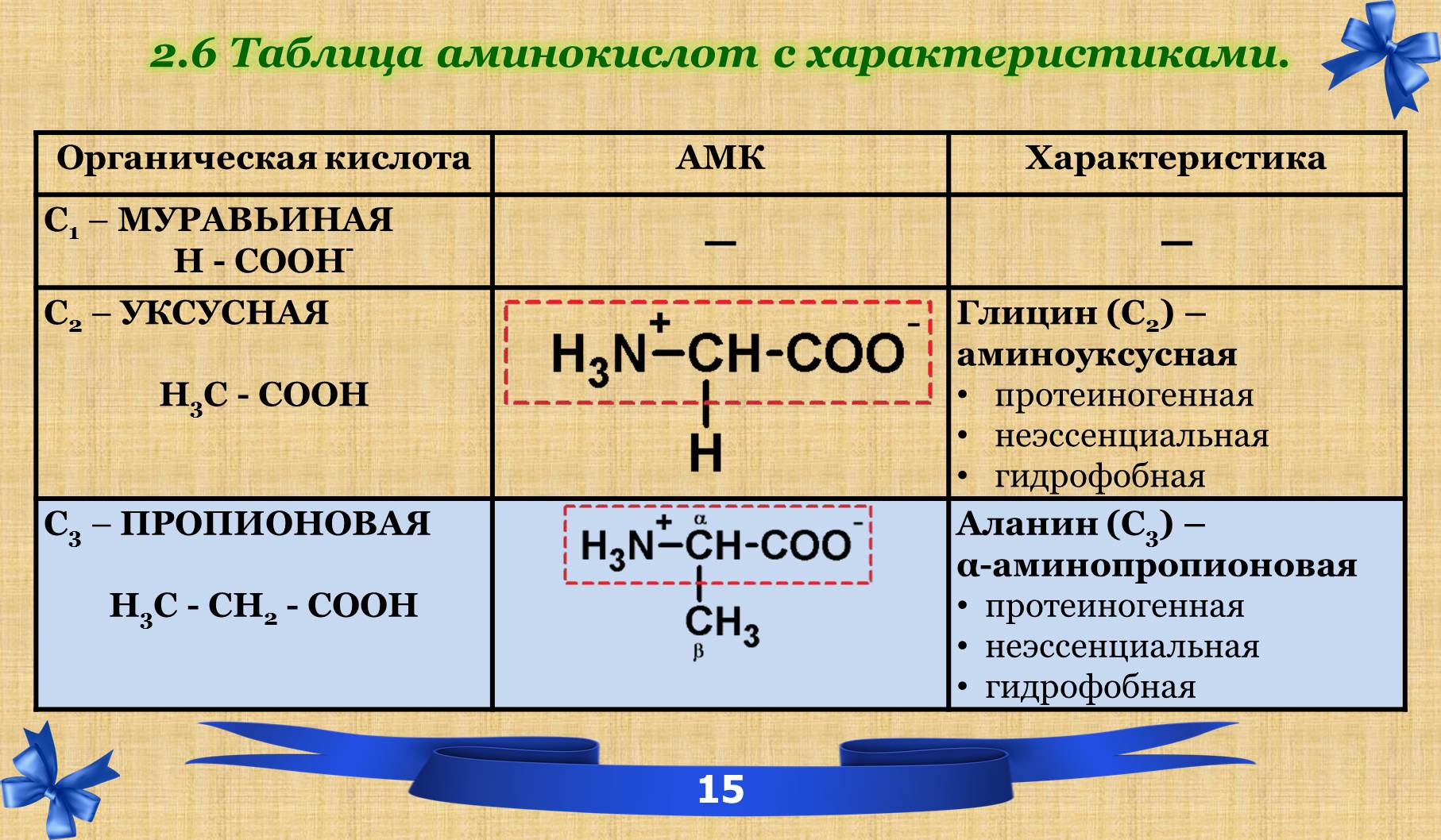
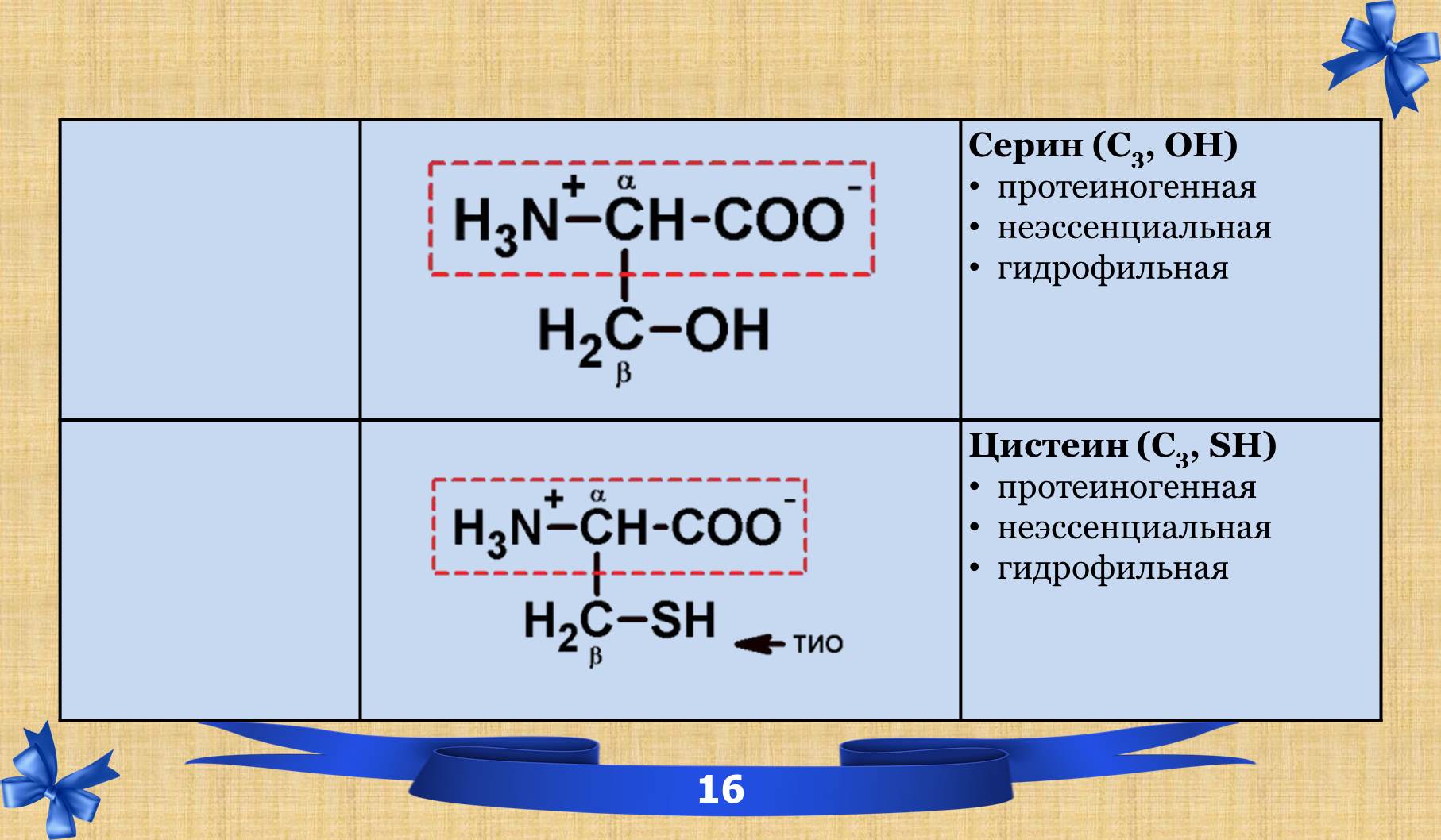
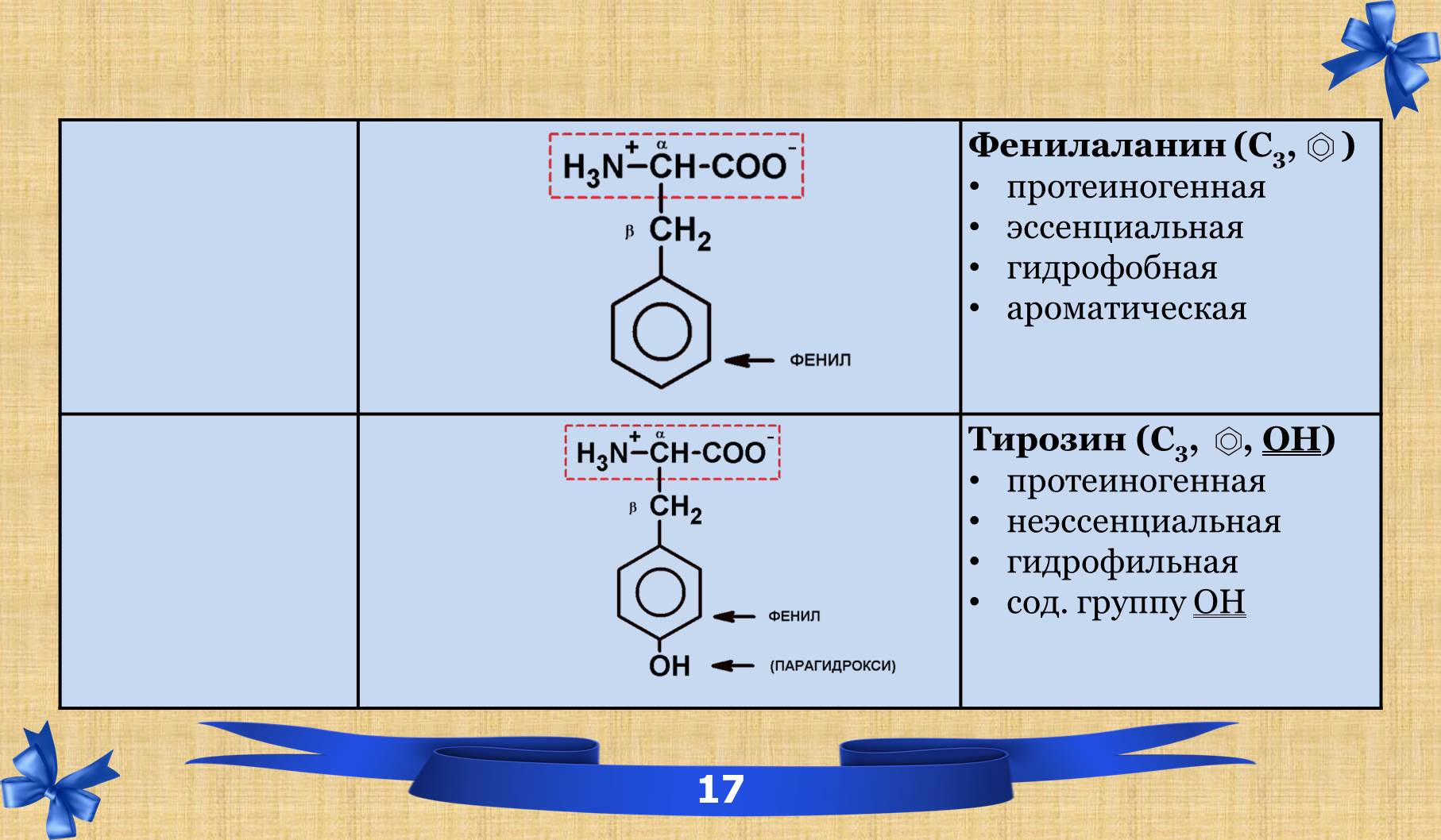
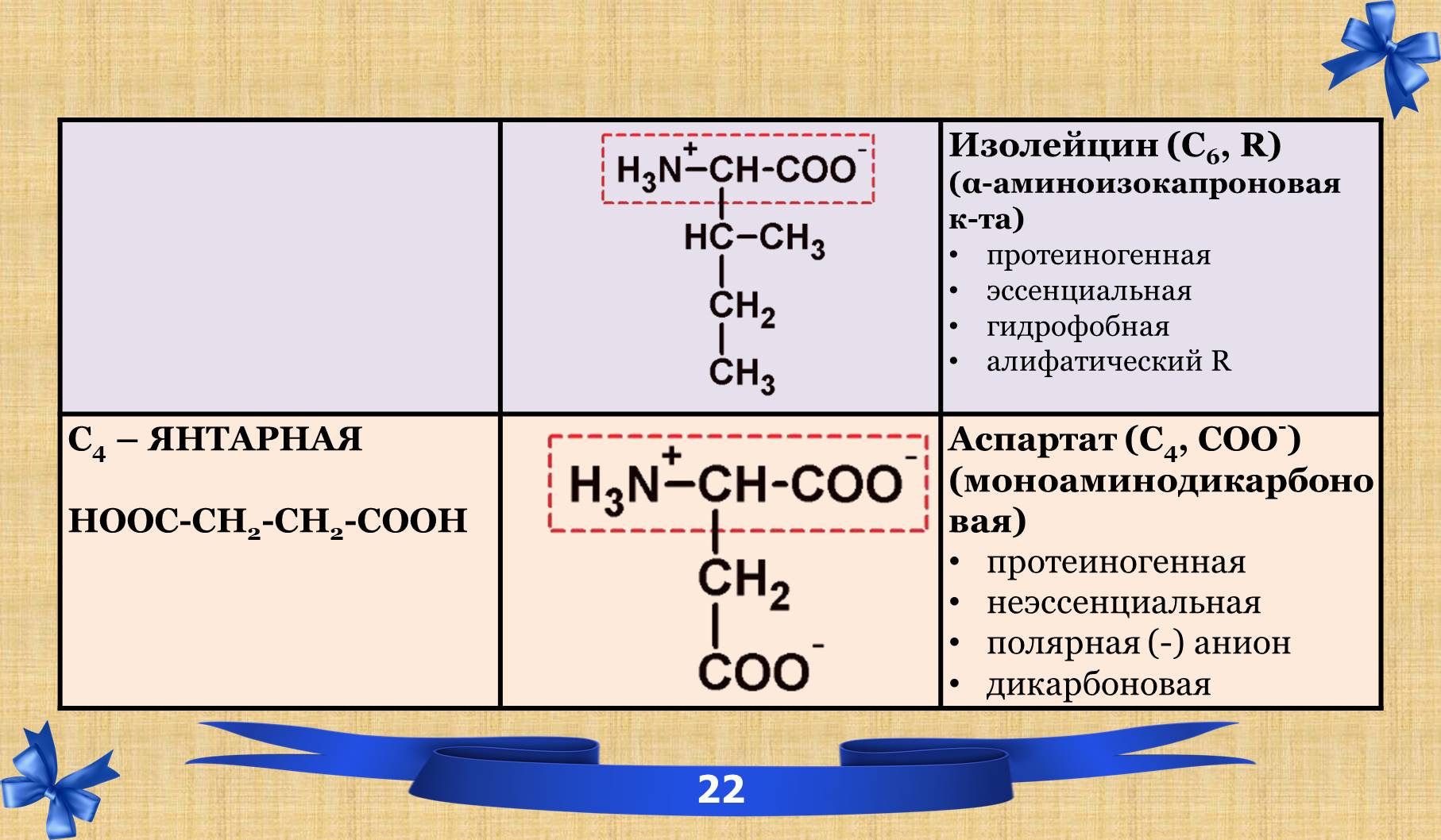
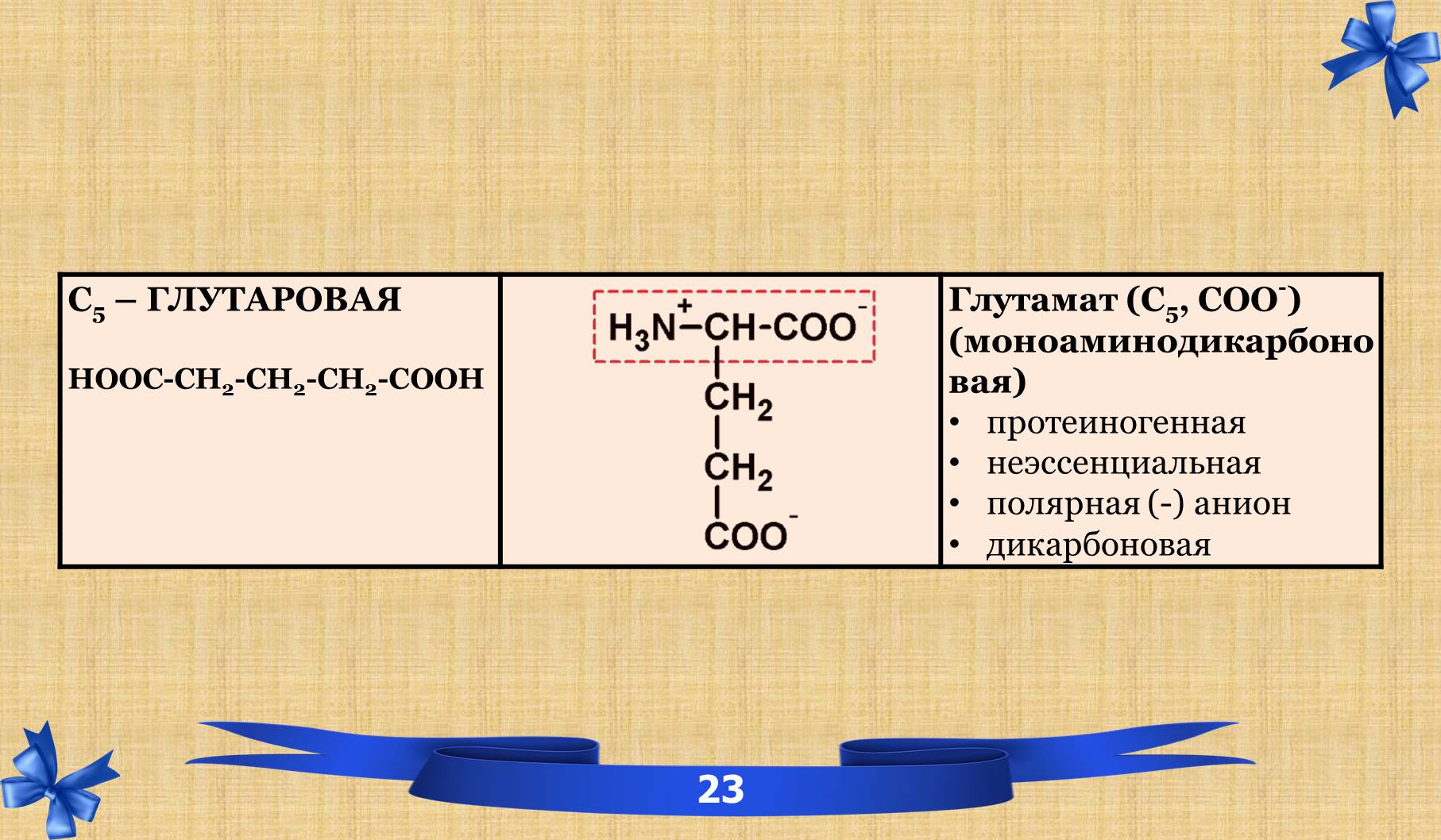
2.6 Таблица аминокислот с характеристиками.
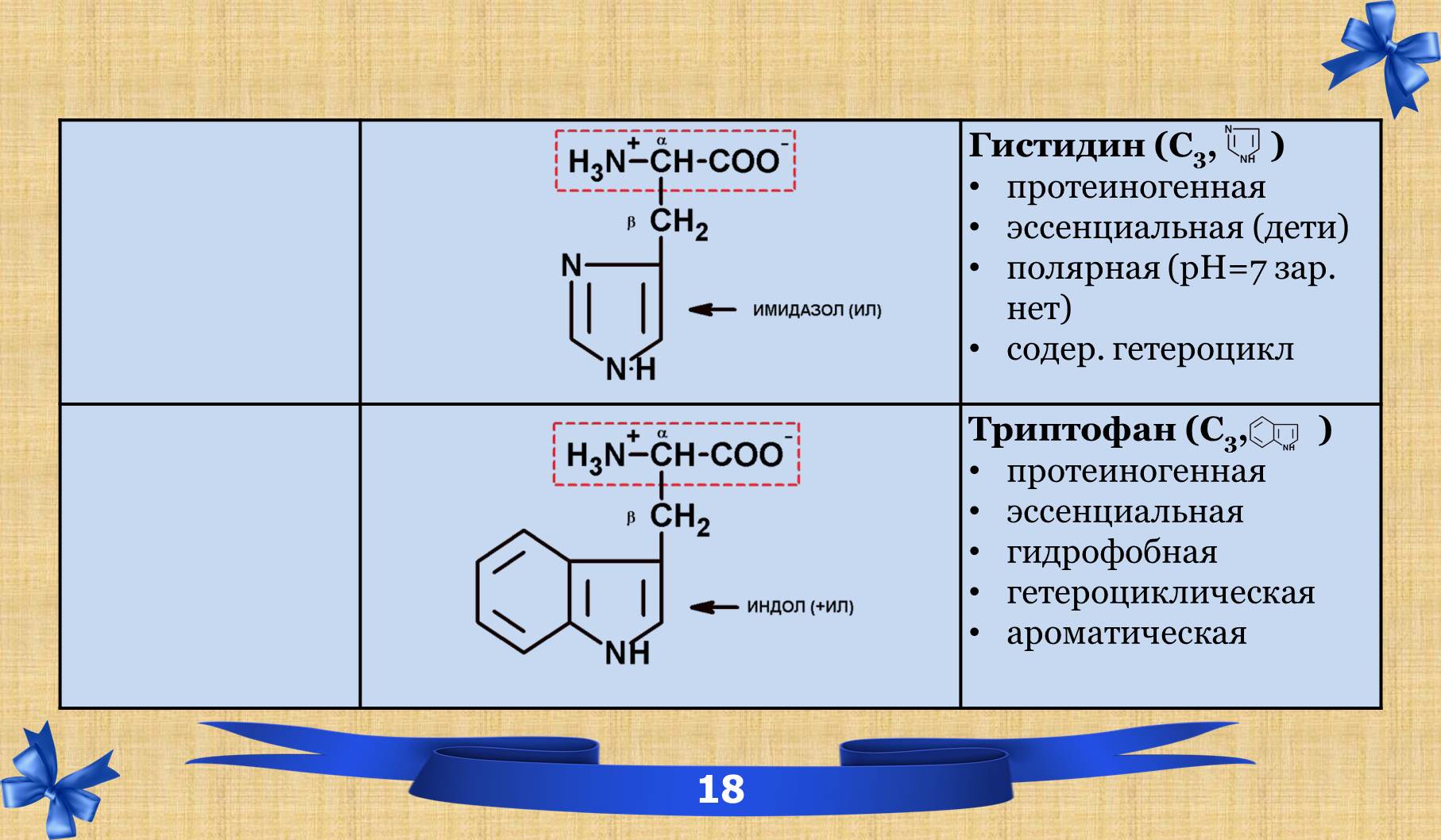
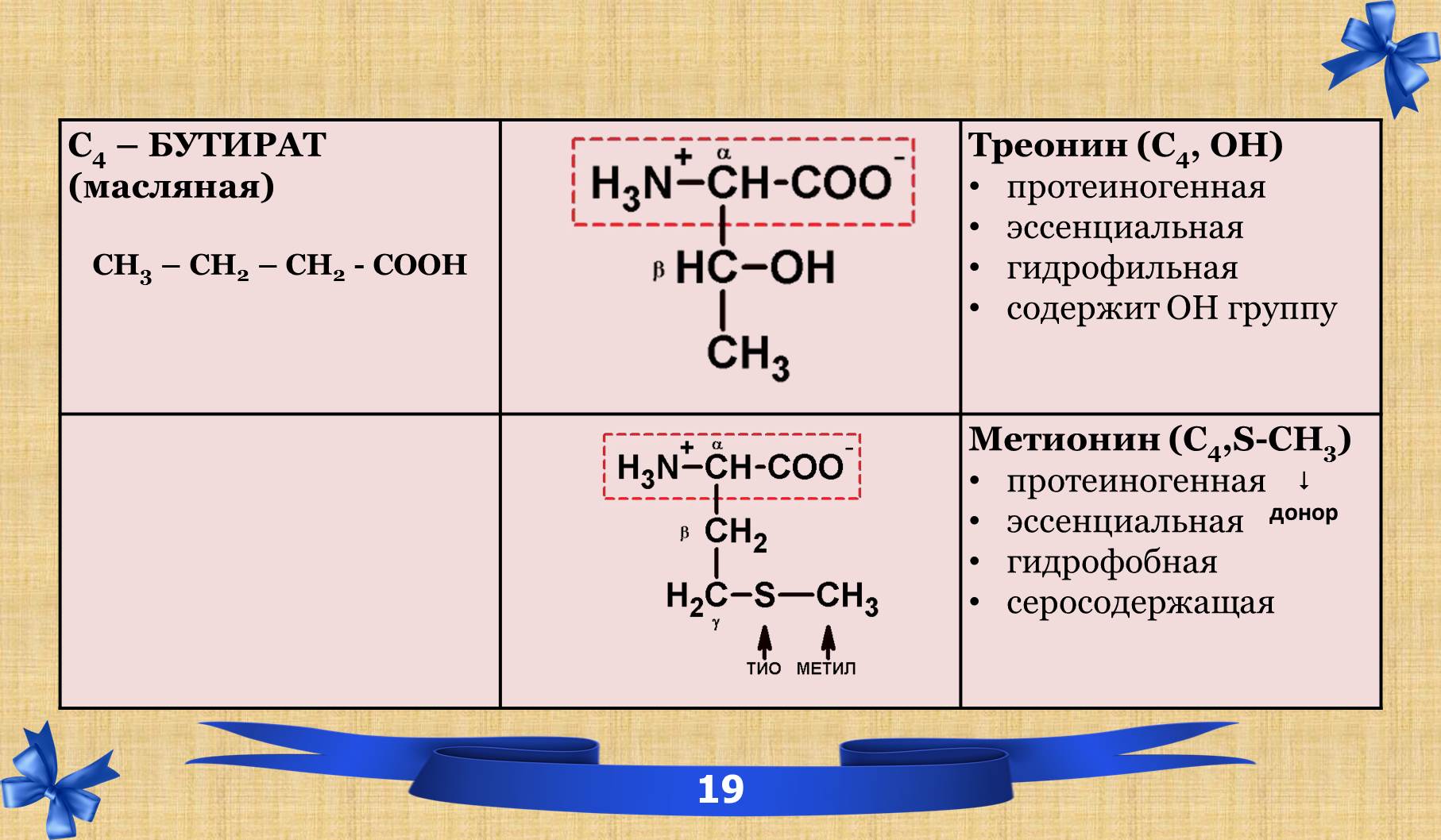
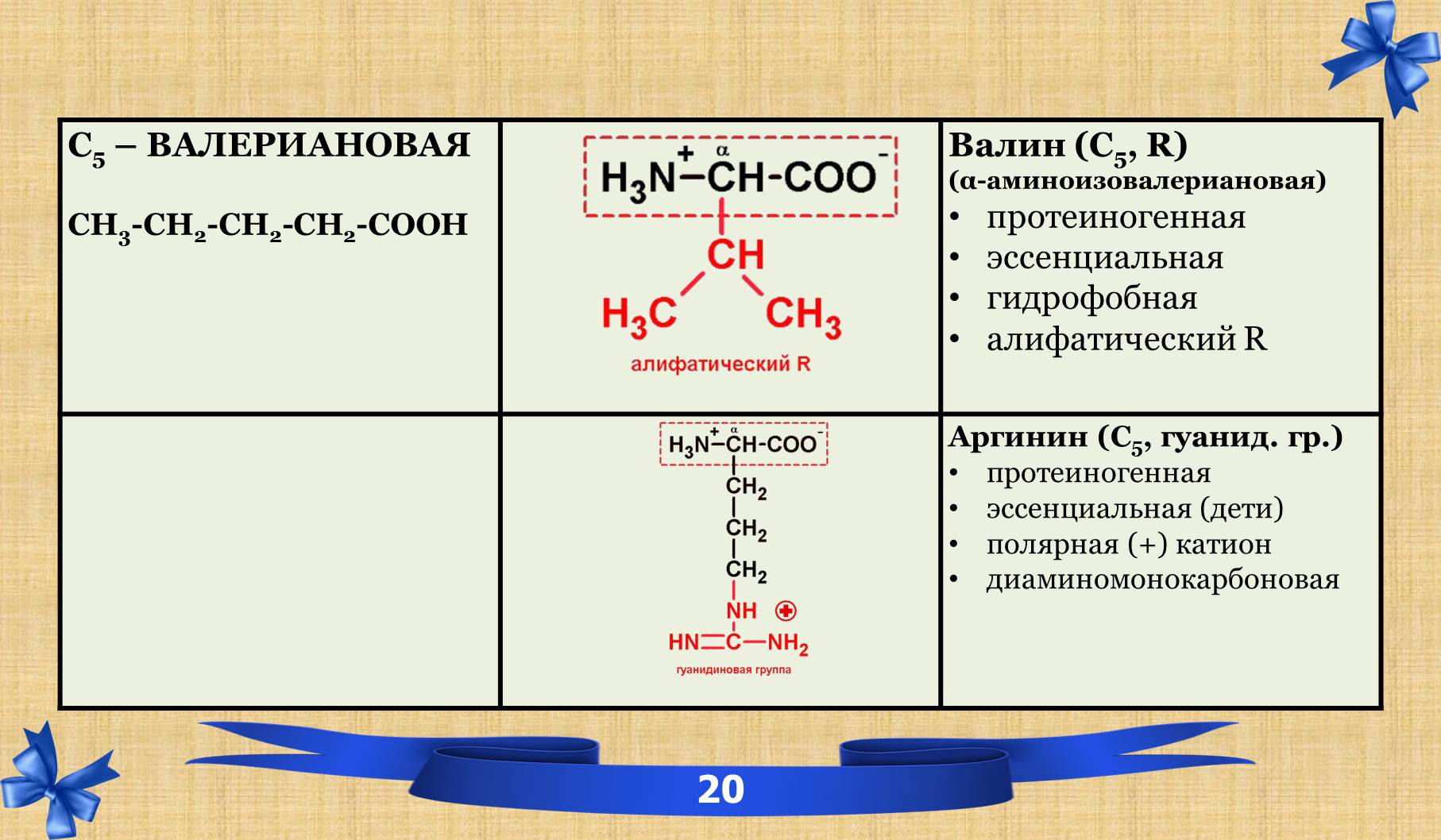
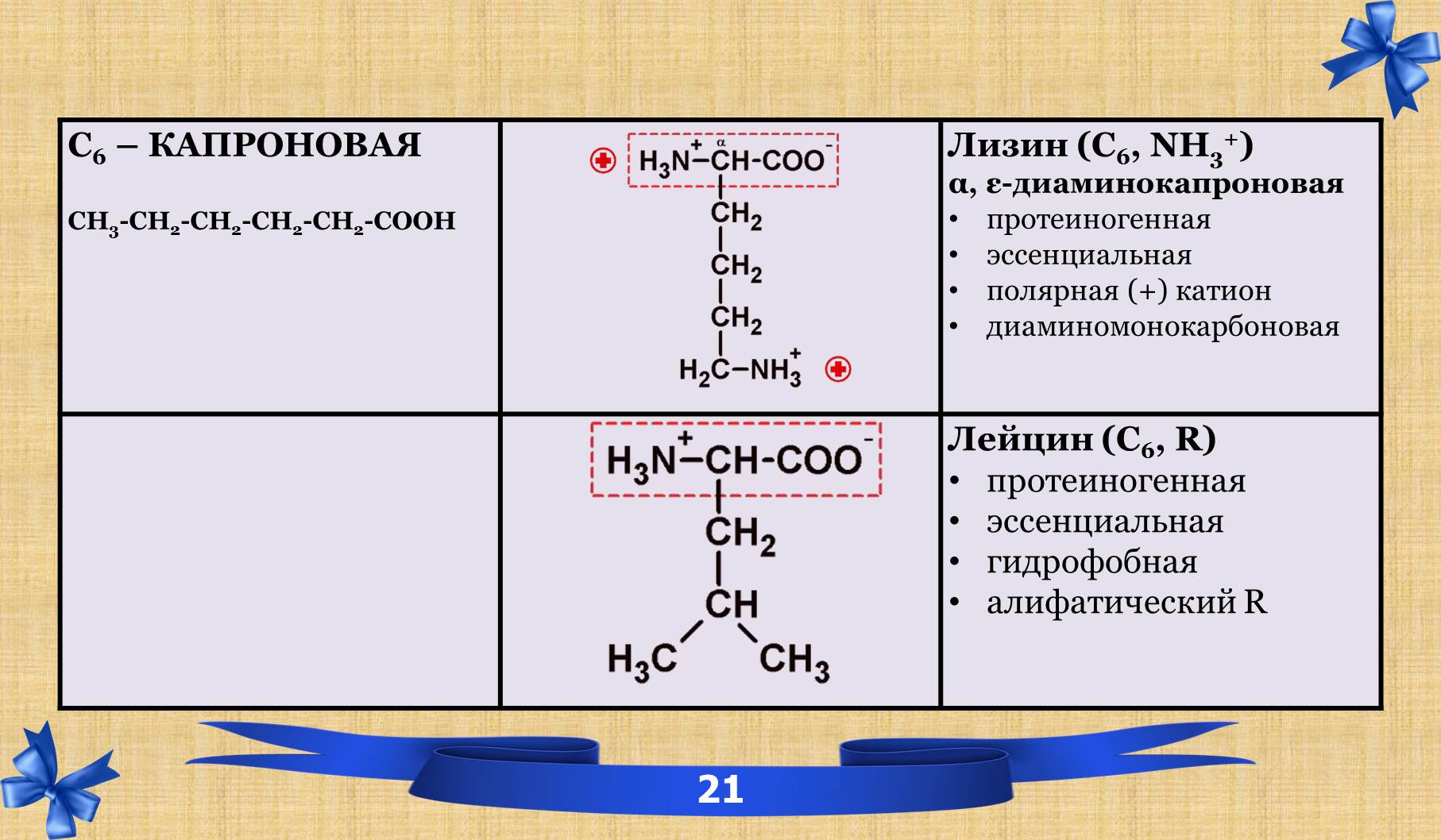
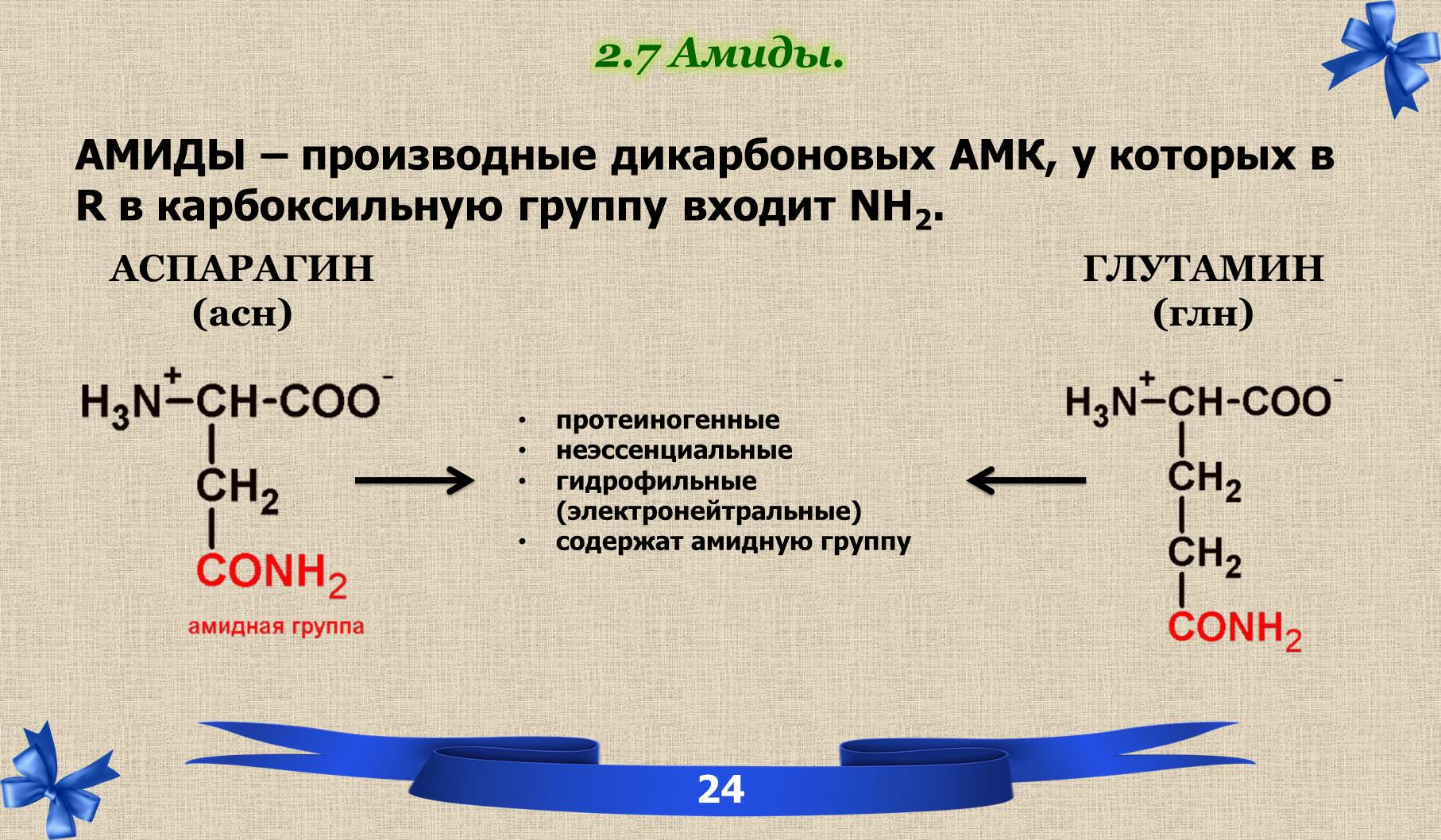
2.7 Амиды.
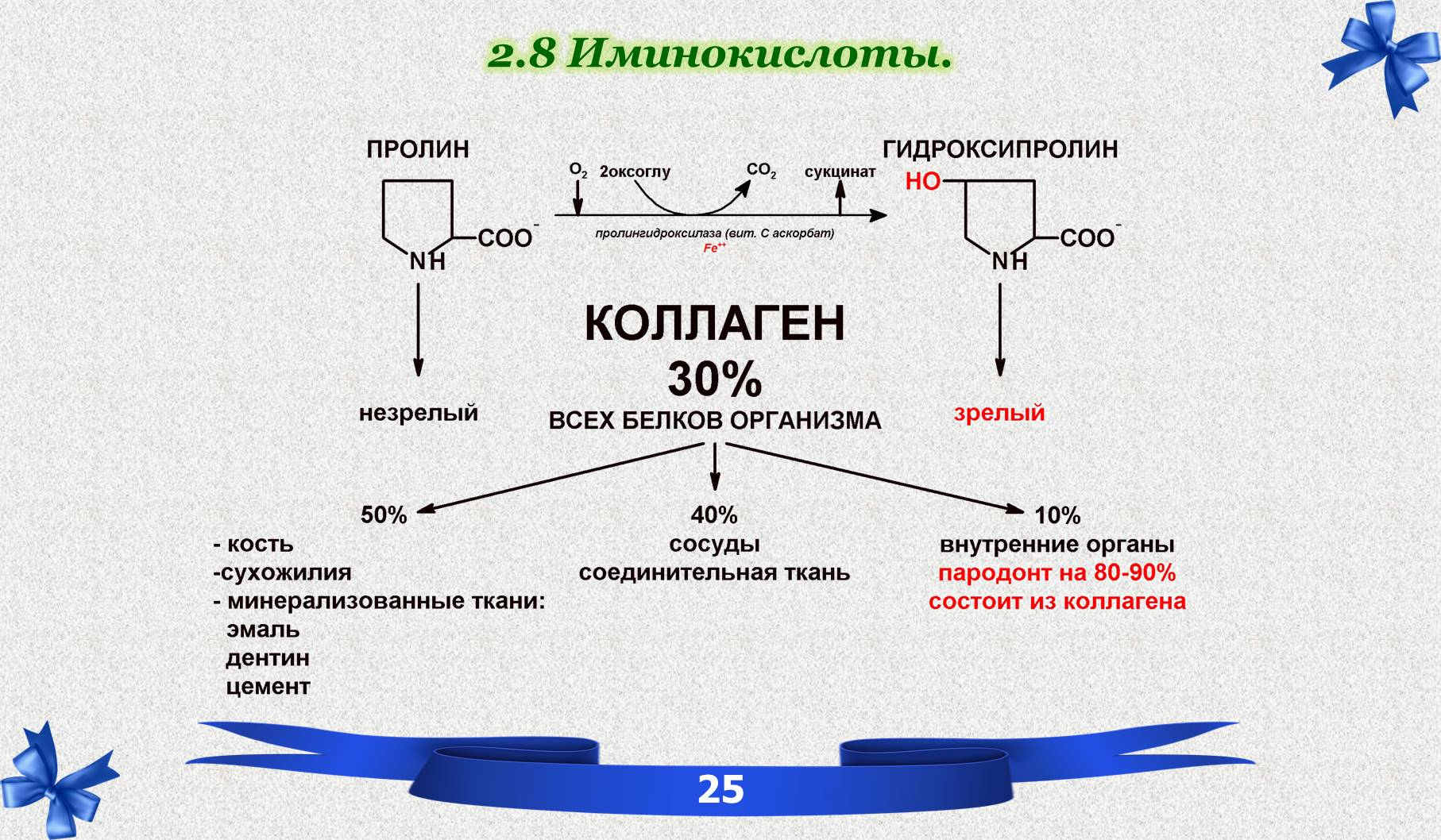
2.8 Иминокислоты.
III. Пептид.
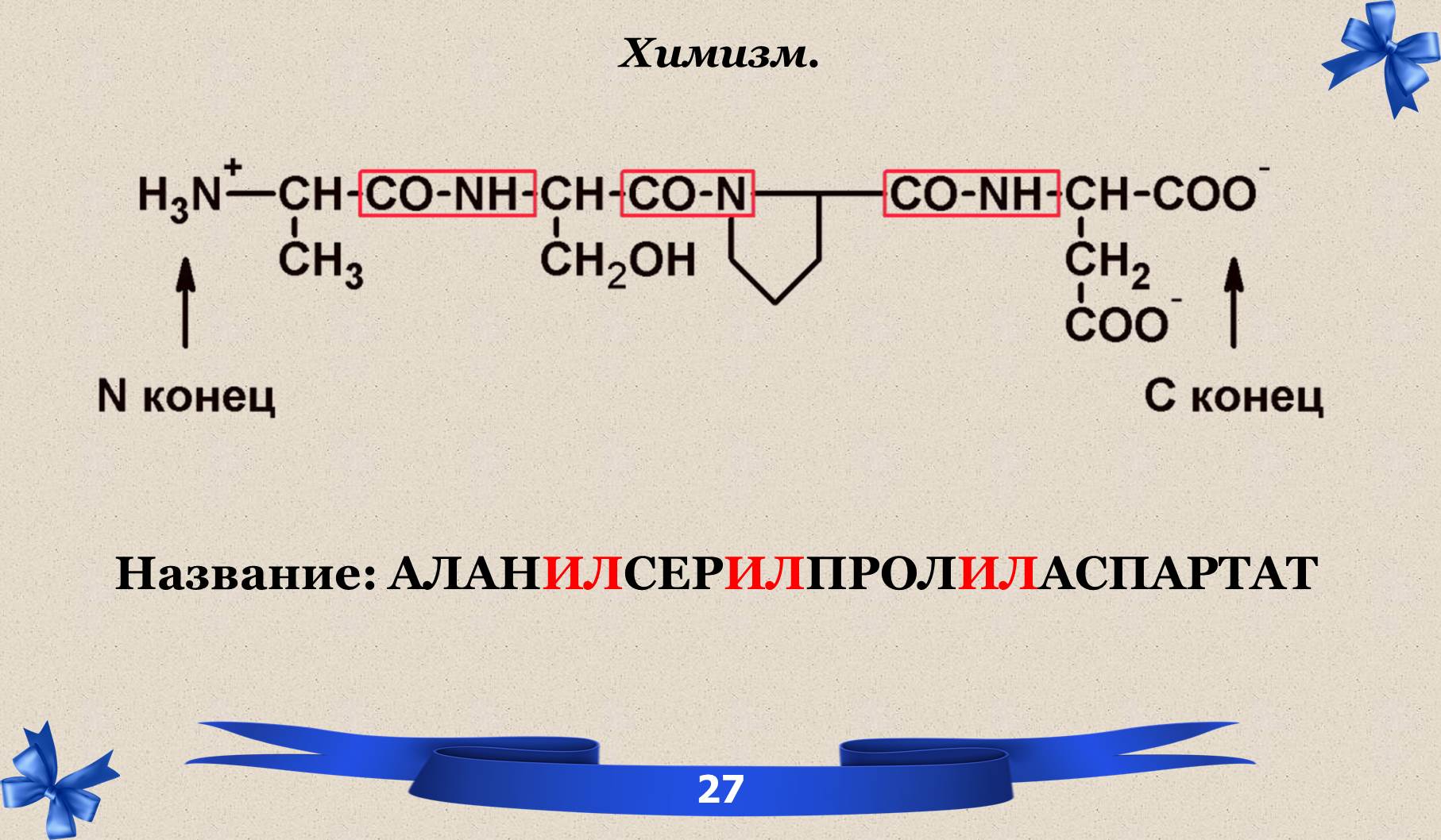
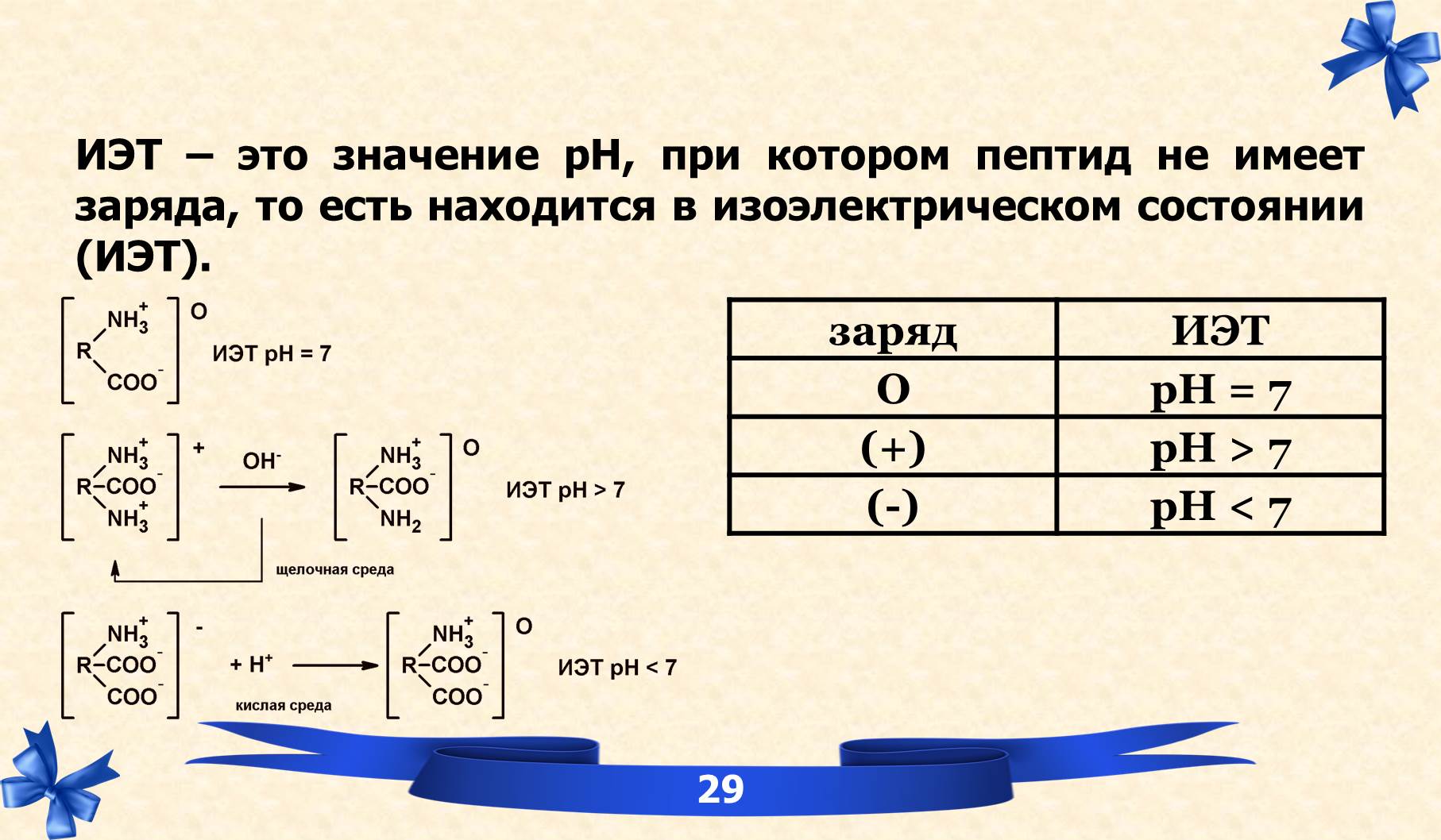
IV. ИЭТ.
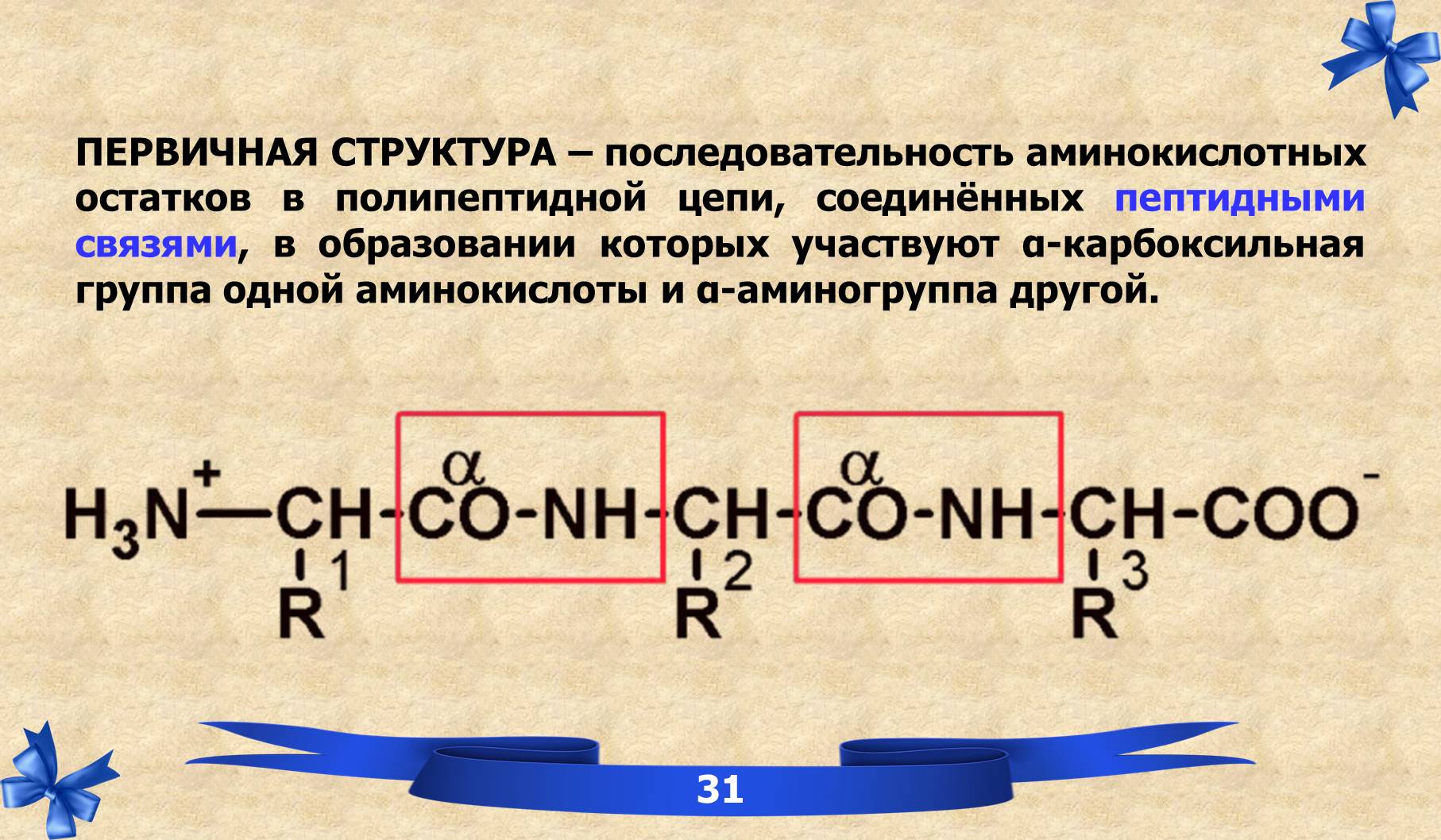
V. Первичная структура белков.
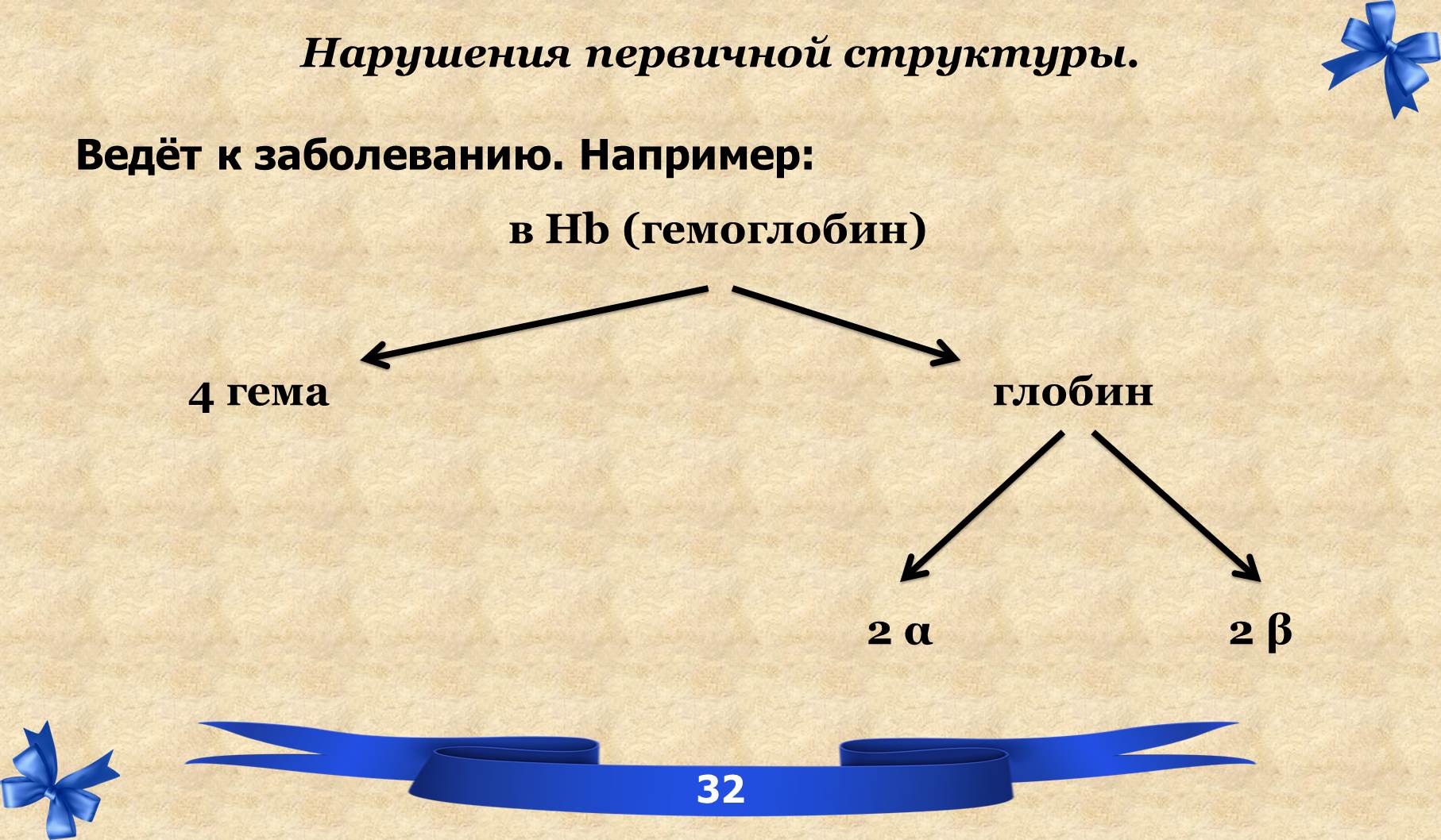

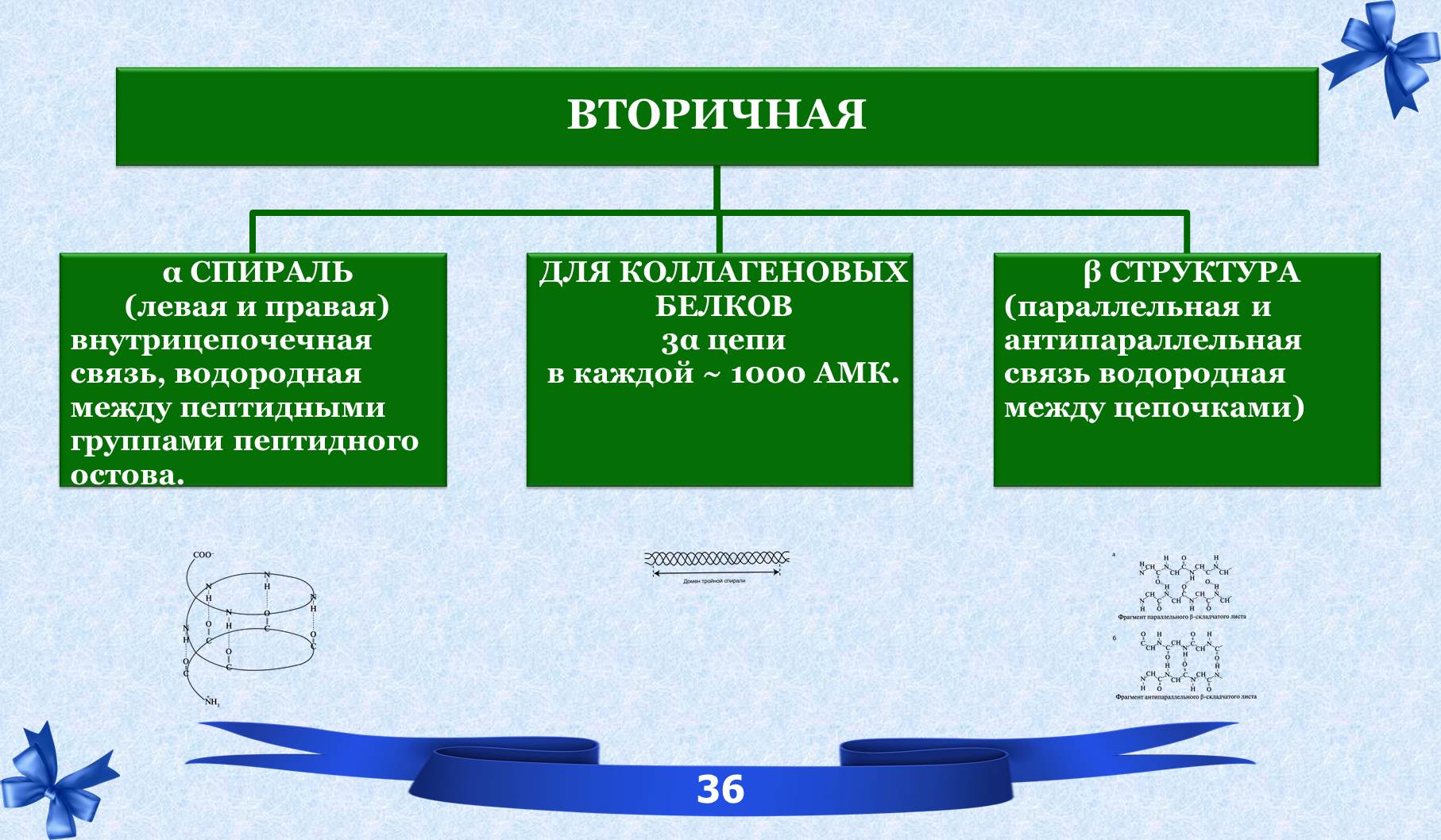
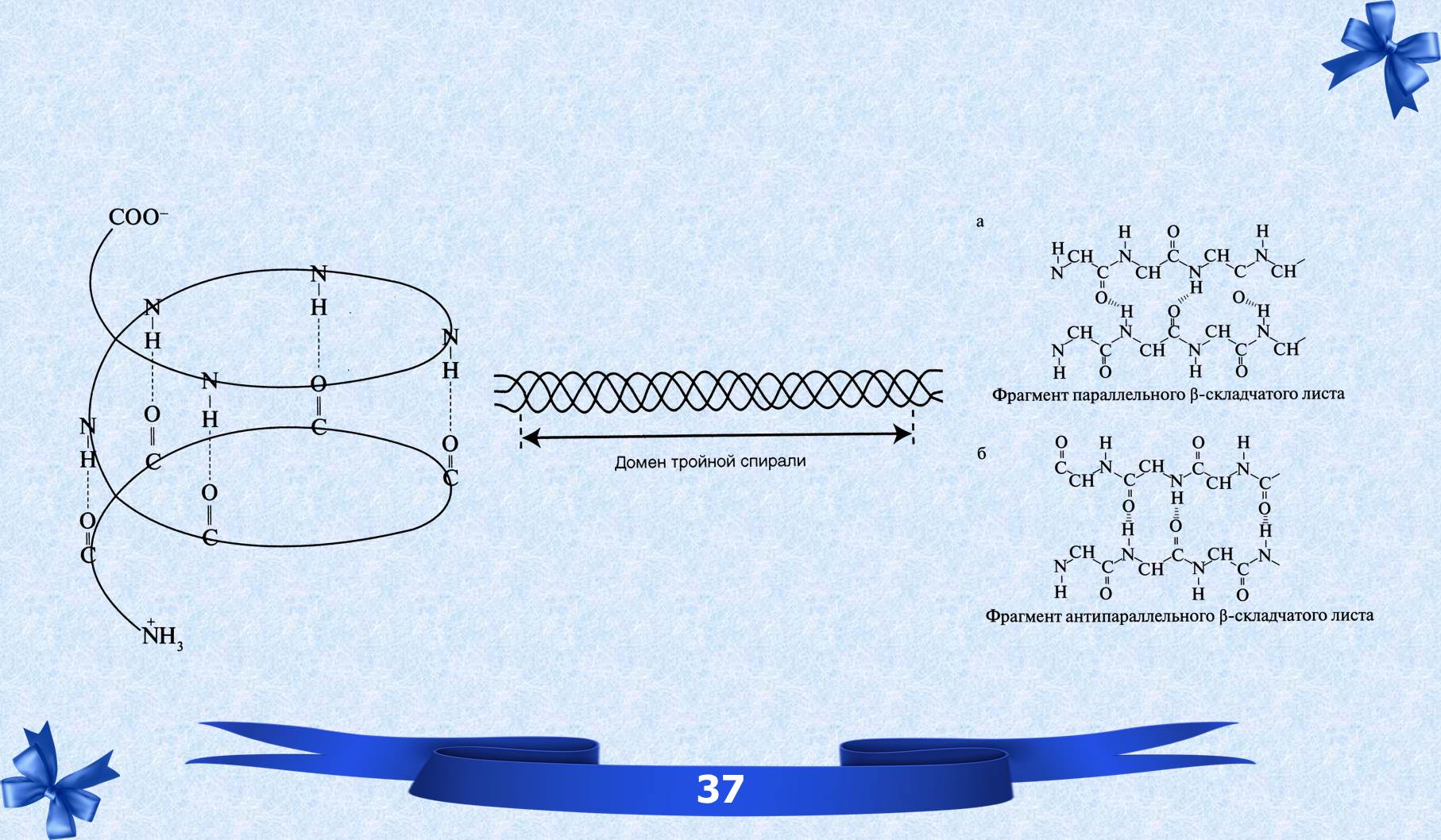
VI. Вторичная структура белков.
ВТОРИЧНАЯ СТРУКТУРА – расположение в пространстве полипептидной цепи, которая стабилизируется водородными связями между функциональными группами пептидного остова.
VII. Третичная структура белков.
ТРЕТИЧНАЯ СТРУКТУРА – пространственная структура, которая поддерживается за счёт связей и взаимодействия между радикалами аминокислотных остатков, расположенных на значительном расстоянии друг от друга.
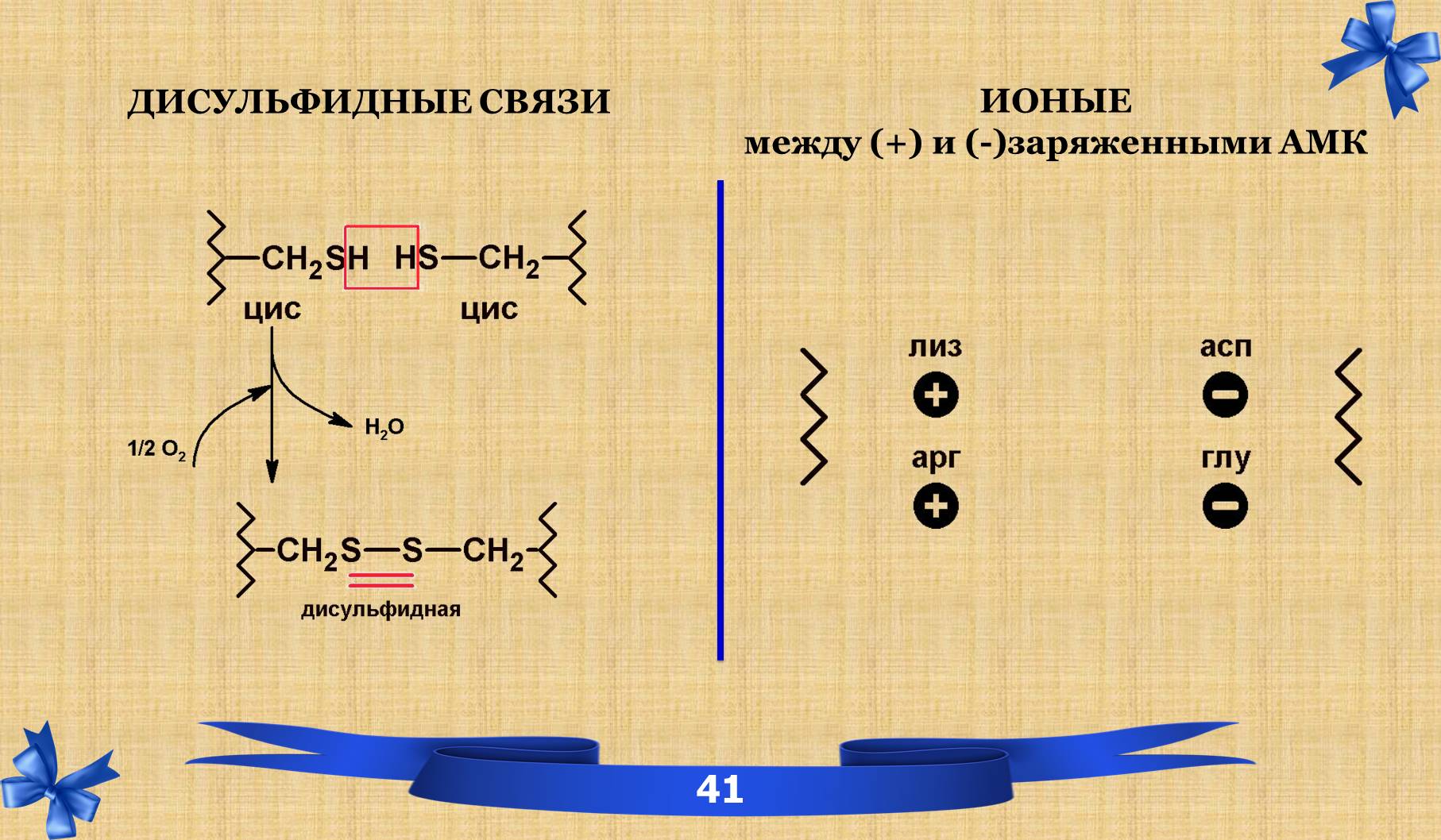
7.1 Связи третичной структуры.
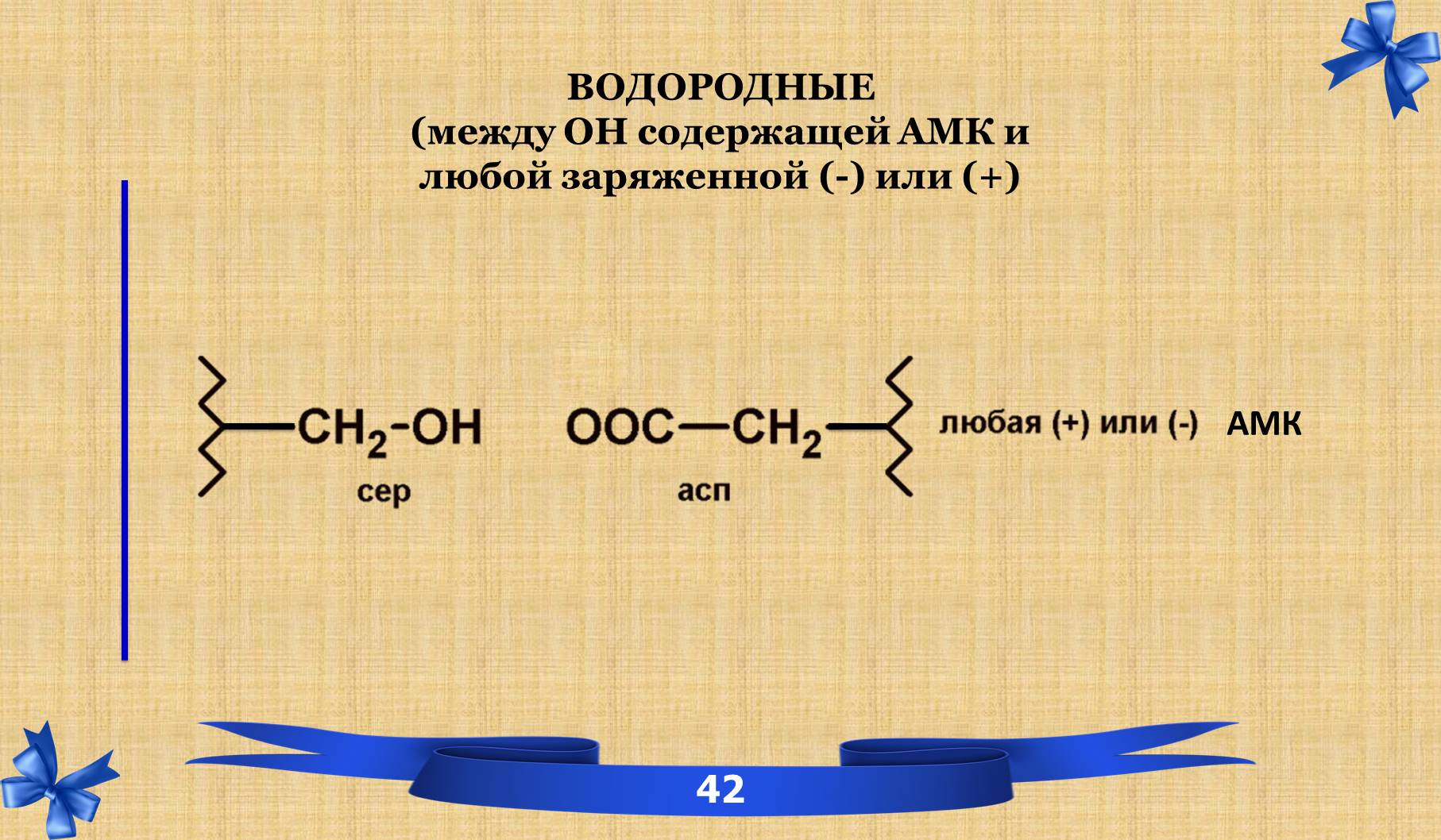
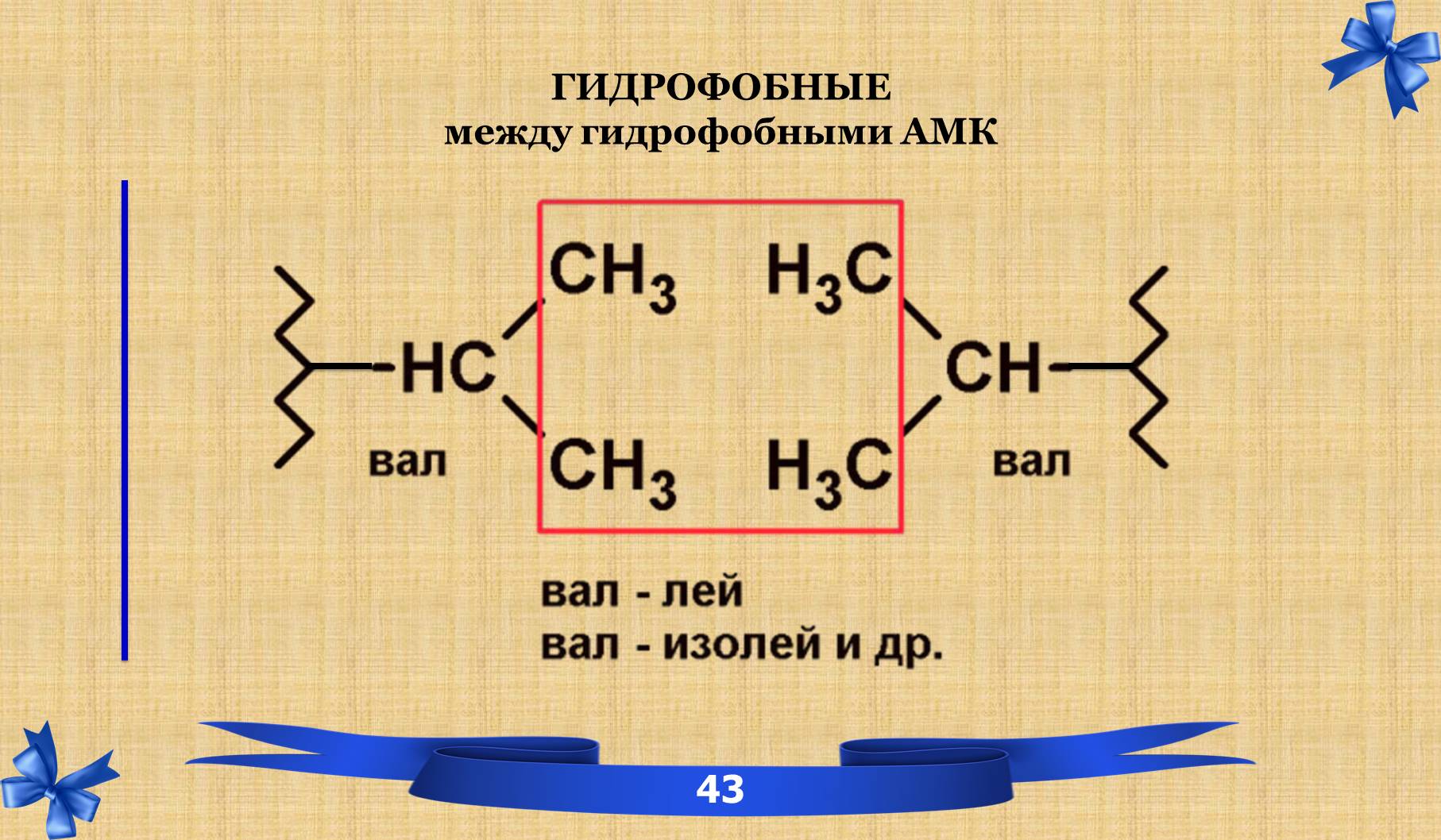
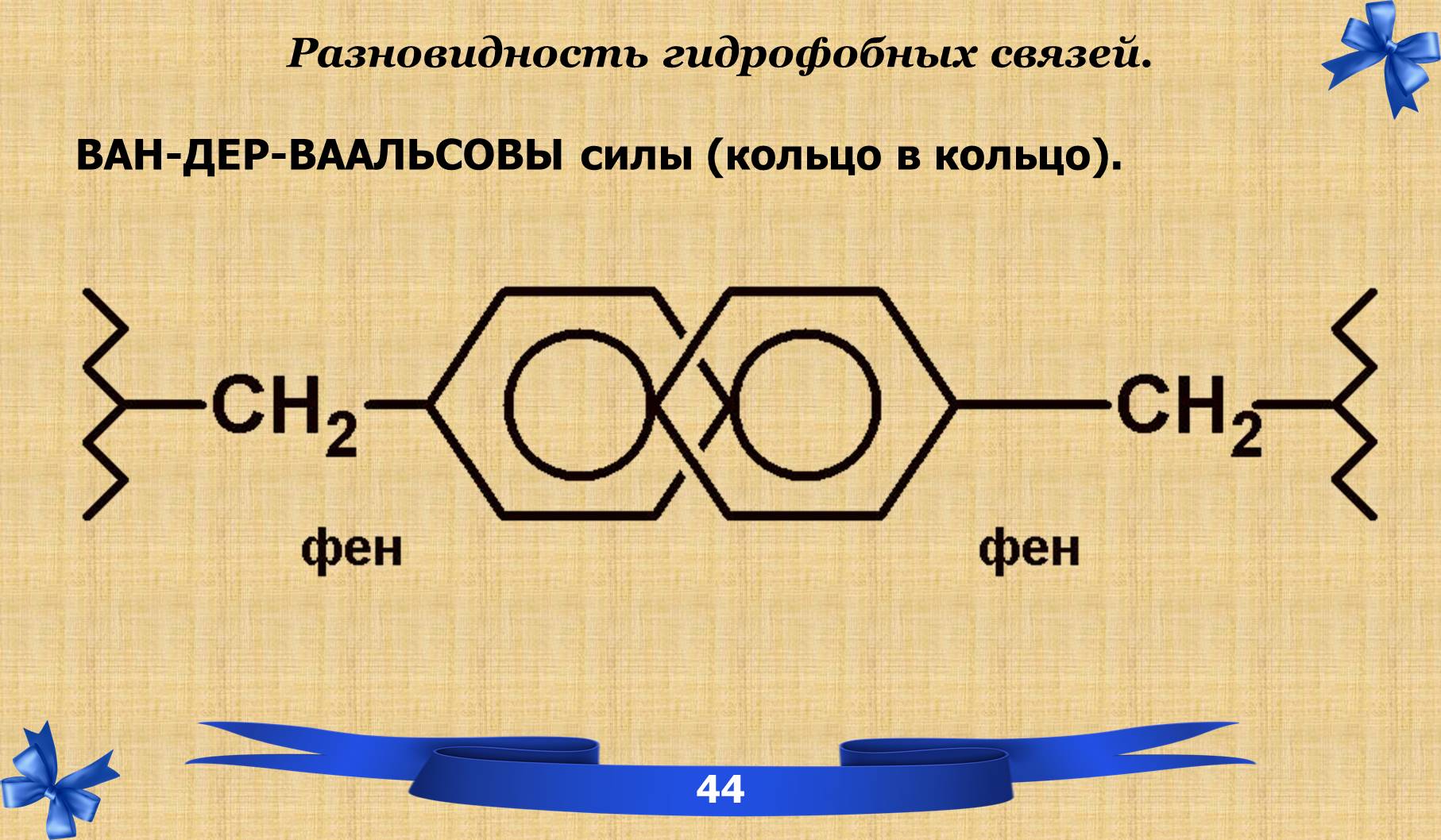
7.2 Понятие фолдинга.
УКЛАДКА – формирование третичной структуры называют – фолдинг. В клетках происходит отбор из множества стерически возможных одной единственной конформации. Из клеток выделено несколько классов белков – шапероны, или белки теплового шока, функция которых обеспечивать правильную укладку полипептидной цепи в процессе посттрансляционной модификации, а также ренатуацию повреждённых белков и стабилизацию белков с неустойчивой конформацией.
7.3 Шапероны.
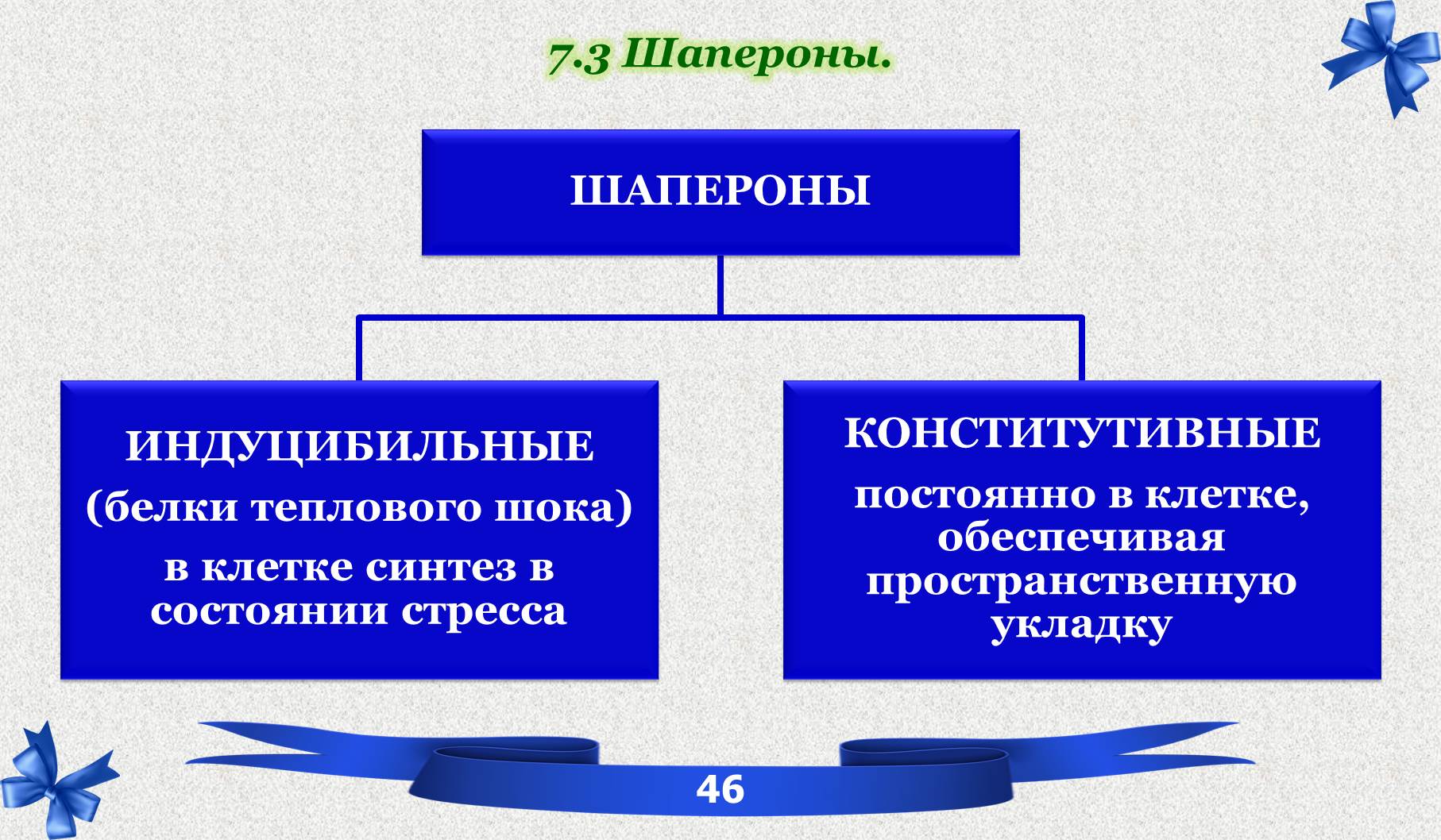
В соответствии с молекулярной массой все шапероны делятся на 6 основных групп. Высокомолекулярные (от 100 до 110 КД)
Ш – 90
Ш – 70
Ш – 60
Ш – 40
низкомолекулярные (от 15 до 30 КД)
7.4 Домен.
ДОМЕН – обособленный участок полипептидной цепи приобретающий пространственную структуру независимую от других участков в процессе формирования третичной структуры и выполняющий определённую биологическую функцию. Так белки крови – альбумины имеют 3 домена, которые выполняют транспортную функцию. По третичной структуре белки делятся на:
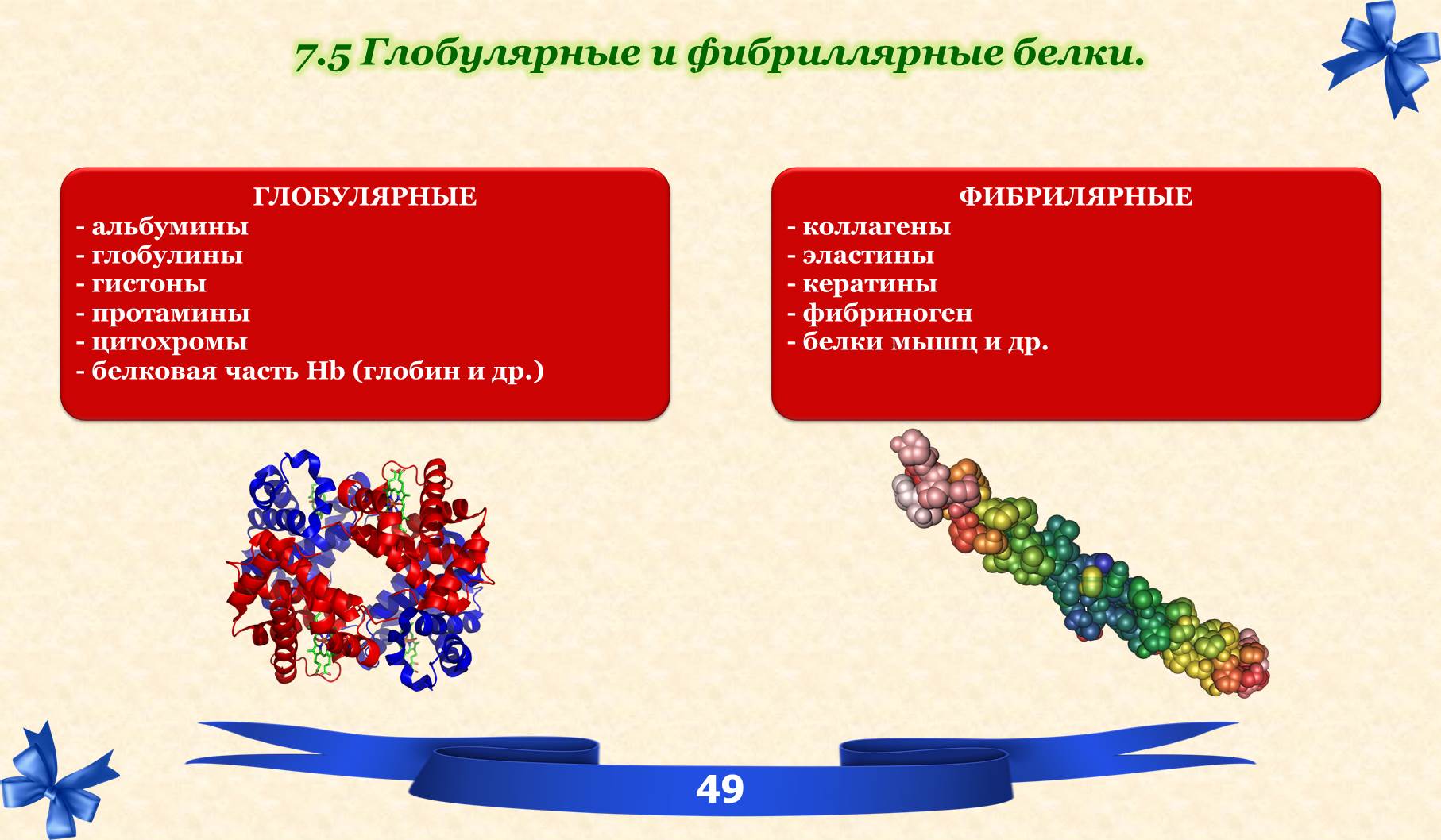
7.5 Глобулярные и фибриллярные белки.
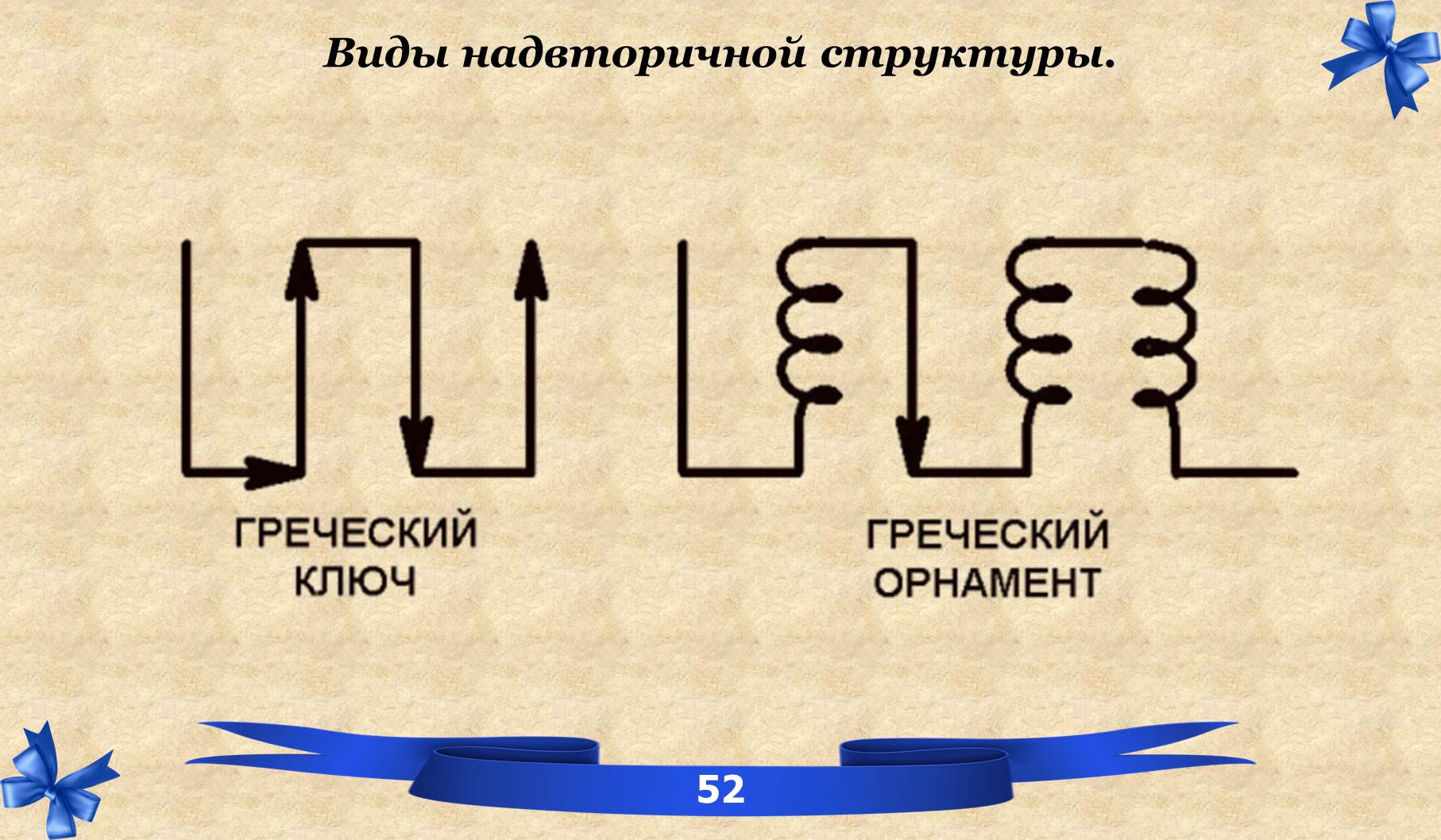
VIII. Надвторичная структура белков.
НАДВТОРИЧНАЯ (супервторичная) структура белков – устойчивое расположение в пространстве α-спиралей и β-структур.
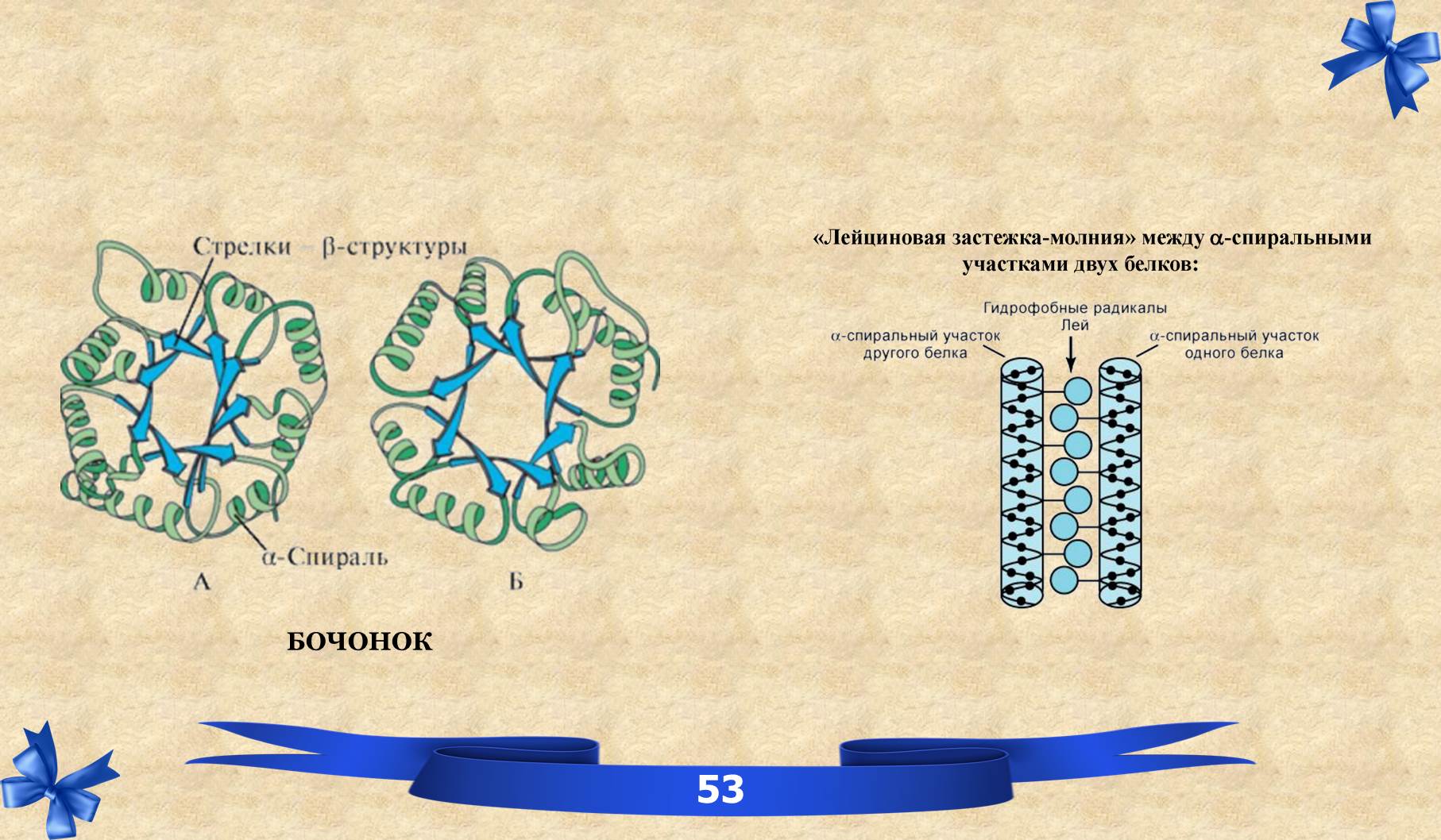
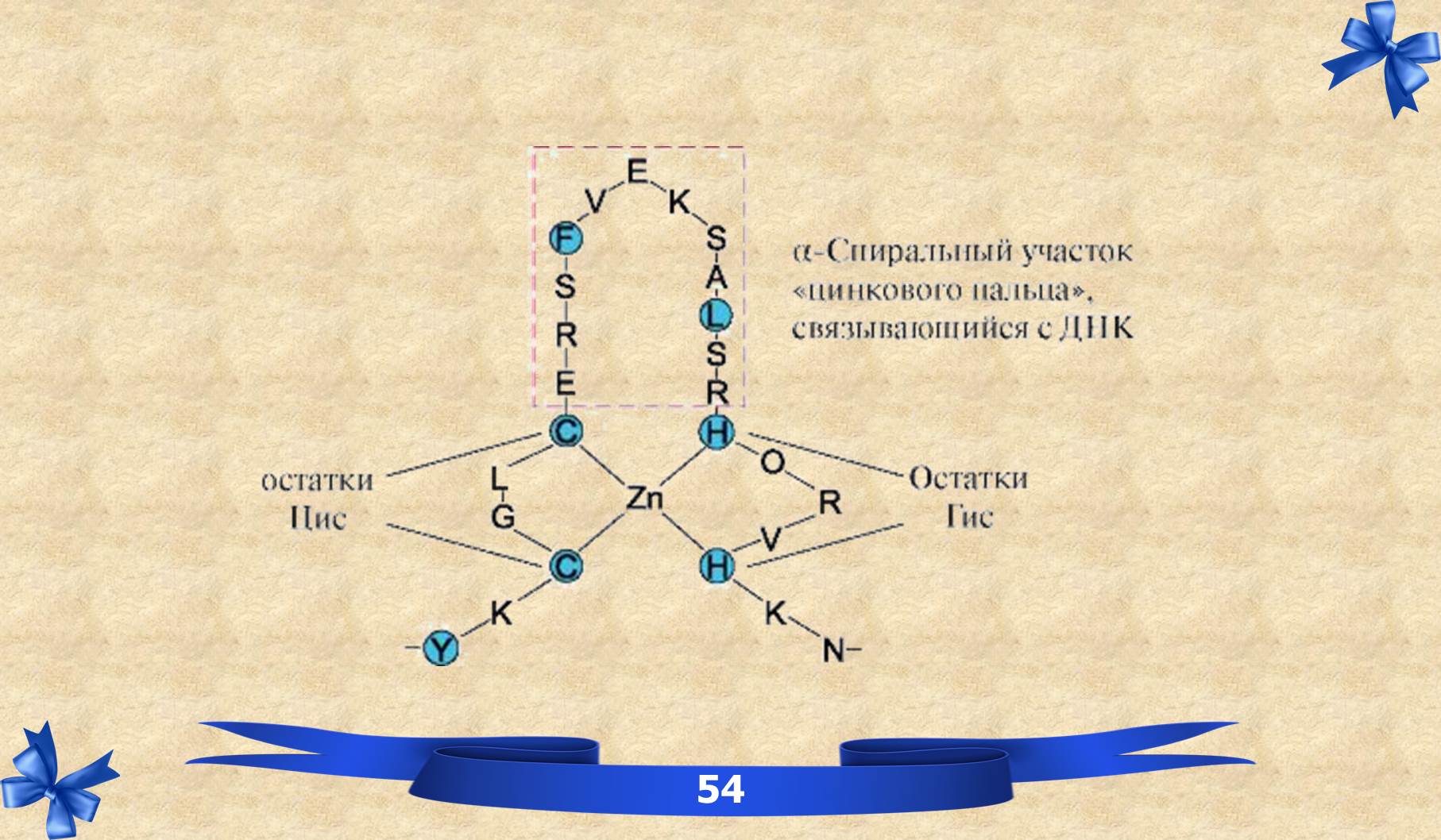
IX. Четвертичная структура белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА – взаиморасположение нескольких полипептидных цепей (протомеров) в пространстве, одну олигомерную структуру. Основные силы, стабилизирующие четвертичную структуру, являются: нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Все белки имеют первичную, вторичную и третичную, лишь некоторые – четвертичную структуру, отсюда они выполняют определённые функции.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Вы ознакомились с фрагментом книги.
Для бесплатного чтения открыта только часть текста.
Приобретайте полный текст книги у нашего партнера:
Всего 10 форматов