
Рабочая тетрадь-тренажер по биохимии
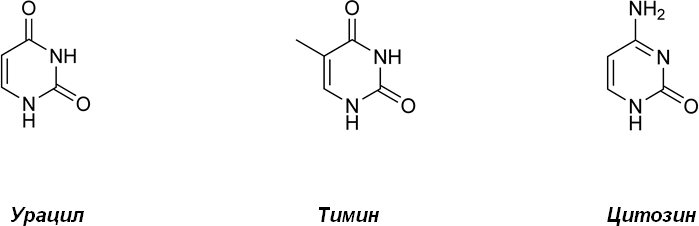
Различают также минорные азотистые основания, которые представляют собой видоизмененные азотистые основания, отличающиеся по строению от аденина, гуанина, урацила и тимина; к ним относятся 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, N6-метиладенин, N-метилгуанин, и др.
Основные термины:Азотистые основания – общее название азотсодержащих гетероциклических органических соединений, входящих в состав нуклеозидов и нуклеотидов
Нуклеозиды – органические природные соединения, состоящие из пиримидинового или пуринового основания, связанного N-гликозидной связью с остатком сахара пентозы
Нуклеотиды – природные или синтетические соединения, у которых гидроксильный остаток пентозы в составе нуклеозида этерифицирован одной или несколькими фосфатными группами
Нуклеиновые кислоты – природные органические соединения – биополимеры, мономерами которых являются мононуклеотиды, связанные 3,5 -фосфодиэфирной связью
Ферменты и коферменты
Ферменты (от лат. fermentum «закваска»), или энзиимы – обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в биологических системах. Ферменты являются биокатализаторами, т. е. ускоряют химические реакции в клетке.
Проферментами зимогенами называют неактивные предшественники ферментов, которые могут активироваться через избирательное расщепление белковой молекулы, реакции фосфорилирования или дефосфорилирования, диссоциации, а также агрегации протомеров и др.
Поскольку все ферменты являются белками, то обладают всеми физико-химическими свойствами белков. По структуре ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор (коэнзим, кофермент).
С химической точки зрения, кофермент – это низкомолекулярное органическое соединение, являющееся составной частью сложного белка, обладающего каталитической активностью; большинство коферментов являются производными водорастворимых витаминов, а также нуклеозидов, пептидов и др.
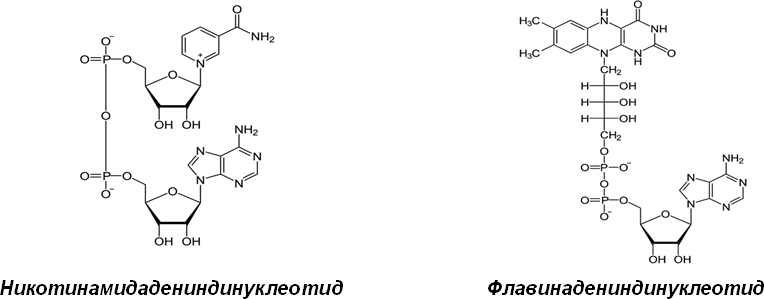
Рис. 3. Структура важнейших коферментов (НАД и ФАД)
Все ферменты, изученные к настоящему времени, включены в особый каталог (классификация ферментов – КФ) и имеют свой классификационный номер, в котором первая цифра указывает на принадлежность к одному из 7 классов ферментов:
1) оксидоредуктазы
2) трансферазы
3) гидролазы
4) лиазы
5) изомеразы
6) лигазы (синтетазы)
7) транслоказы
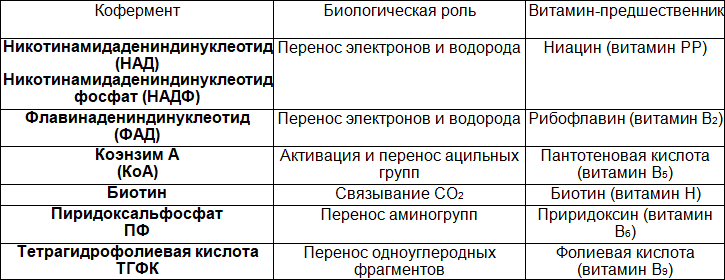
Таблица 7. Взаимосвязь витаминов и коферментов
Принципиальная структура фермента включает:
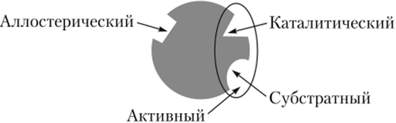
а) активный центр фермента – это уникальная комбинация аминокислотных остатков белковой молекулы, участвующих в присоединении и превращении субстрата, формируется на уровне третичной структуры. В активном центре выделяют субстратсвязывающий (якорный) участок и каталитический участок.
б) аллостерический центр – участок фермента, расположенный вне активного центра и присоединяющий низкомолекулярный аллостерический эффектор.
Примерами аллостерических эффекторов являются низкомолекулярные лиганды, вызывающие изменение активности фермента вследствие их связывания в аллостерическом центре (НАД+, НАДН, АТФ, АДФ и др.).
Изучение ферментов (энзимов) выделено в отдельную науку – энзимологию. Все ферменты имеют белковую природу, чем объясняются их свойства (термолабильность, зависимость активности от рН среды, высокоспецифичное действие по отношению к реагирущим веществам – субстратам ферментативной реакции).
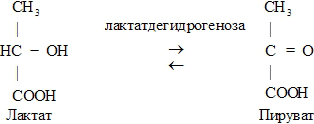
Рис. 4. Пример ферментативной реакции с участием оксидоредуктазы
Важнейшей характеристикой ферментативной реакции является константа Михаэлиса (КM) – это величина, характеризующая сродство фермента к субстрату; численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной скорости (Vmax).
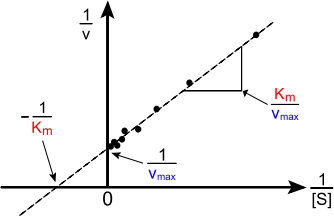
Рис. 5. Графическое изображение ферментативной реакции в обратных координатах
На активность фермента могут повлиять различные факторы. Существуют разные типы ингибирования ферментов.
Таблица 8. Типы ингибирования ферментов
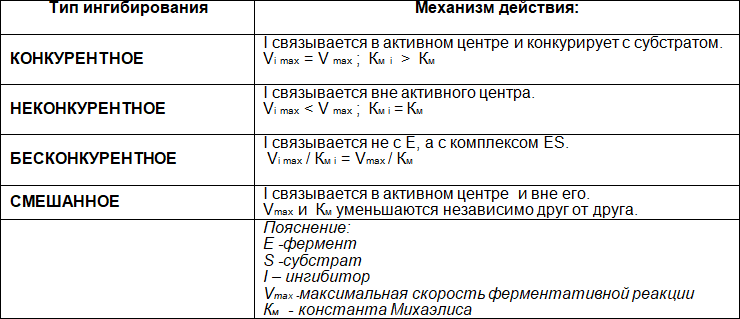
Конкурентное ингибирование – подавление скорости ферментативной реакции веществами, структурно сходными с субстратом. В этом случае, ингибитор связывается с активным центром фермента и вытесняется из него при повышении количества вступающего в реакцию субстрата; ингибирование характеризуется увеличением константы Михаэлиса (КM) без изменения максимальной скорости реакции (Vmax).
Другой вариант – неконкурентное ингибирование – подавление скорости ферментативной реакции веществами, не имеющими структурного сходства с субстратом и связывающимися не с активным центром, а в аллостерическом центре. В данном случае, блокируется каталитическое превращение субстрата, поэтому снижается максимальная скорость реакции, а величина константы Михаэлиса (КМ) не меняется.
Активность ферментов выражается в каталах (количество фермента, которое превращает 1 моль субстрата за 1 с), а также в международных единицах (Е) (количество фермента, превращающего 1 мкмоль субстрата за 1 мин).
Помимо отдельных ферментов известны и мультиферментные комплексы: пируватдегидрогеназный комплекс (пируватдегидрогеназа, ПДК), превращающий пируват в ацетил-SКоА, α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА, комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
Основные термины:Ферменты (энзимы) – биологические катализаторы белковой природы
Энзимодиагностика – направление медицины, которое осуществляет диагностику заболеваний, основанную на определении изменения активности ферментов (изоферментов) в биологических жидкостях и тканях
Энзимология – раздел биохимии, изучающий строение, свойства и механизм действия ферментов
Энзимопатия – общее название патологических состояний, развивающихся вследствие отсутствия или изменения активности каких-либо ферментов (фенилкетонурия, гистидинемия, гликогенозы, галактоземия, липидозы, мукополисахаридозы).
Энзимотерапия – направление медицины, которое использует ферменты в качестве лекарственных препаратов
Витамины
Витамины – эссенциальные (жизненно важные) факторы питания человека и животных, необходимые для протекания разнообразных химических процессов в организме. Витамины участвуют в обмене веществ как в качестве коферментов – непосредственных участников ферментативных реакций (витамины группы B, витамин РР), так и в виде регуляторов отдельных процессов (витамины С, А, Е, К, D).
Провитамины – вещества, поступающие с пищей или синтезируемые в организме и являющиеся источником витаминов; например, из 7-дегидрохолестерола под влиянием ультрафиолетовых лучей образуется витамин D3.
Классификация витаминов:
• Жирорастворимые витамины: А (ретинол), D (кальциферол), E (токоферол), K (нафтохинон), F (полиненасыщенные жирные кислоты).
• Водорастворимые витамины: B1 (тиамин), B2 (рибофлавин), B3 =РР (никотинамид), B5 (пантотеновая кислота), B6 (пиридоксин), B9= ВC (фолиевая кислота), B12 (цианкобаламин), H (биотин), C (аскорбиновая кислота).
• Витаминоподобные вещества: жирорастворимые – Q (убихинон), водорастворимые – B4 (холин), P (биофлавоноиды), BT (карнитин), B8 (инозит), U (S-метилметионин), N (липоевая кислота), B13 (оротовая кислота), B15 (пангамовая кислота).
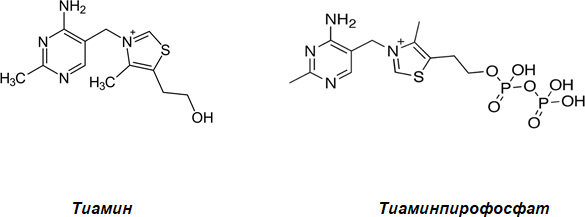
Рис. 6. Тиамин и его кофермент тиаминпирофосфат, синоним тиаминдифосфат (ТПФ, ТДФ)
Основным источником витаминов являются пищевые продукты растительного и животного происхождения, и лишь некоторые из них (фолиевая кислота, биотин, витамин К) способны синтезироваться микрофлорой кишечника. При недостатке в организме того или иного витамина или нарушении его обмена (всасывания в кишечнике, транспорта кровью, превращения в кофермент) возникают состояния, называемые гиповитаминозами. Жирорастворимые витамины при увеличении дозы накапливаются и могут вызывать гипервитаминозы с рядом общих симптомов (потеря аппетита, расстройство ЖКТ, сильные головные боли, повышенная возбудимость нервной системы, выпадение волос, шелушение кожи) и со специфическими признаками. Яркая картина гипервитаминозов отмечается только для витаминов А и D.
Определение витаминов в продуктах питания, микробиологических средах, а также стандартизация препаратов витаминов представляют большой практический интерес.
План описания витамина:• Химическое название, буквенное обозначение, классификационная характеристика (водорастворимый, жирорастворимый)
• Химическое строение (химическая формула витамина, составные части (подписать), активная форма витамина/ кофермент с формулами)
• Источники (в каких продуктах питания содержится)
• Суточная потребность
• Особенности метаболизма (всасывание, распределение, превращение)
• Биохимические функции (биологическая роль, механизм действия)
• *названия ферментов, примеры биохимических реакций (не менее 2 реакций!)
• Антивитамины (если они выявлены): названия и формулы
• Название и проявления гиповитаминоза и авитаминоза
*Гипервитаминозы (для вит D)
Основные термины:Витамины – незаменимые низкомолекулярные органические молекулы, разнообразные по химической структуре (производные азотсодержащих гетероциклов, изопреноиды, гидроксикислоты и др.), но имеющие высокую биологическую активность в организме вследствие образования активных форм или коферментов
Витаминоподобные вещества – группа условно незаменимых факторов питания, участвующих в отдельных биохимических и физиологических процессах, при их недостаточном поступлении с пищей не наблюдается развития патологических изменений
Провитамины (предшественники витаминов) – вещества, поступающие с пищей или синтезируемые в организме и являющиеся источником витаминов
Гормоны
Гормоны – биологически активные вещества, синтезируемые в незначительных количествах эндокринными железами и клетками диффузно-эндокринной системы. Гормоны осуществляют гуморальную регуляцию обмена веществ и имеют различную химическую структуру. Уникальность гормональной регуляции обусловлена соподчинённостью работы желёз внутренней секреции, ауторегуляцией выработки гормонов и агонизмом-антагонизмом их действия относительно друг друга. Существует строгая иерархия или соподчиненность гормонов Поддержание уровня гормонов в организме в большинстве случаев обеспечивает механизм отрицательной обратной связи (см. рисунок).
Согласно классификации по химическому строению различают 4 группы гормонов:
1. Гормоны – производные аминокислот
адреналин, норадреналин, тироксин, трийодтиронин.
2. Пептидные гормоны
адренокортикотропный гормон (АКТГ), соматотропный гормон, тиреотропный гормон (ТТГ), лактотропный гормон (пролактин), лютеинизирующий гормон, фолликулостимулирующий гормон, меланоцитстимулирующий гормон, антидиуретический гормон (АДГ, вазопрессин), окситоцин, кальцитонин, паратгормон, инсулин, глюкагон.
3. Стероидные гормоны
кортизол, альдостерон, эстрадиол, прогестерон, тестостерон, кальцитриол.
4. Эйкозаноиды
простагландины, лейкотриены, тромбоксаны
Для проявления биологической активности гормона, обязательным условием является его взаимодействие с рецепторами. Существуют два основных механизма действия гормонов на уровне клетки: реализация эффекта через рецептор, расположенный на мембране и реализация эффекта через рецептор, расположенный внутри клетки.
Для реализации мембранного механизма важнейшую роль в клетке приобретают вторичные посредники (мессенджеры) – это внутриклеточные низкомолекулярные молекулы, регулирующие скорость метаболических процессов в клетке и образующиеся в ответ на связывание гормона с мембранным рецептором (ионы Са2+, 3,5 – цАМФ, 3,5 – цГМФ, инозитол-1,4,5-трифосфат, монооксид азота (NО)).
На практике, всегда следует учитывать возможные результаты взаимодействия совместной работы гормонов.
Синергизм – однонаправленное действие двух или нескольких гормонов. Например, адреналин и глюкагон активируют распад гликогена печени до глюкозы и вызывают увеличение уровня сахара в крови.
Антагонизм всегда относителен. Например, инсулин и адреналин оказывают противоположные действия на содержание глюкозы в крови. Инсулин вызывает гипогликемию, адреналин – гипергликемию. Биологическое же значение этих эффектов сводится к одному – улучшению углеводного питания тканей.
В медицинской практике гормональные препараты используют для лечения заболеваний желез внутренней секреции. Так, например, инсулин применяют для лечения диабета.
План описания гормона• Химическое название, классификационная характеристика (липофильный, гидрофильный и др.)
• Химическое строение (химическая формула, составные части (подписать))
* для пептидных гормонов указывается – пептидный (количество аминокислотных звеньев)
• Особенности синтеза и секреции и биотрансформации (место синтеза, схема синтеза, регуляция синтеза и секреции, инактивация и выведение гормона)
• Биохимические функции
а) механизм действия (схема или рисунок),
б) мишени и эффекты)
• Описание гипофункции и гиперфункции эндокринной железы, синтезирующей данный гормон (названия заболеваний, основные симптомы)
Основные термины раздела:Гормоны – группа органических веществ различного строения (пептиды, белки, стероиды), секретируемые в кровь эндокринными железами и специализированными клетками в крайне малых количествах и оказывающие регулирующее воздействие на метаболические процессы в организме
Нейромедиатор (нейротрансмиттер) – химический посредник, освобождающийся из пресинаптического нервного окончания и передающий нервный импульс в синапсе постсинаптичсскому окончанию, мышечному волокну или железе, которые эти нервы иннервируют.
Нейромедиаторы центральной нервной системы
• ацетилхолин,
• норадреналин,
• дофамин,
• серотонин,
• Ɣ-аминомасляная кислота (ГАМК)
Нейромедиаторы периферической нервной системы
• ацетилхолин
• норадреналин
Рецептор – высокомолекулярное вещество (как правило гликопротеины), специфически связывающееся с конкретным лигандом. Выделяют два класса рецепторов – мембранные и ядерные.
Вопросы для самоконтроля
• Перечислите функции белков.
• Перечислите методы выделения и очистки белков из биообъектов.
• Дайте определение понятиям: высаливание, хроматография, электрофорез, кристаллизация.
• Перечислите физико-химические свойства аминокислот.
• Составьте формулы аминокислот, образующихся в результате постсинтетической химической модификации (оксилизин, селеноцистеин, ɣ-карбоксиглутаминовая кислота, 3,5-дийодтирозин).
• Перечислите химические реакции для открытия и определения аминокислот в гидролизатах белков.
• Перечислите физико-химические свойства белков.
• Дайте определение понятиям: денатурация, иозоэлектрическая точка, изоионная точка, лактамная (кетонная) форма, лактимная (енольная) форма.
• Перечислите методы определения первичной структуры белков.
• Опишите вторичную структуру белка.
• Дать определение понятиям: протомер (мономер, субъединица), олигомер (мультимер), изофермент, комплементарность.
• Назовите примеры простых белков
• Приведите примеры природных пептидов.
• Опишите гемопротеины.
• Опишите флавопротеины.
• Опишите нуклеопротеины.
• Опишите липопротеины.
• Перечислите фосфопротеины.
• Дать определение понятиям: гликоконьюгаты, гликобиология, гликопатология, гликотерапия.
• Опишите интерфероны и иммуноглобулины
• Опишите трансферрин и гемосидерин.
• Перечислите методы выделения нуклеиновых кислот из биообъектов.
• Составьте формулы минорных нуклеотидов пуринового ряда (инозин, ксантин, гипоксантин, 7-метилгуанозин).
• Перечислите минорные пиримидиновые основания.
• Каковая первичная структура нуклеиновых кислот?
• Какова вторичная структура нуклеиновых кислот?
• Дайте определение понятию «Фермент» (энзим).
• Назовите области применения ферментов.
• Дать определение понятиям: холофермент, простетическая группа, апофермент, кофермент, активный центр фермента, аллостерический центр, синзимы.
• Приведите примеры изоферментов.
• Опишите механизм действия ферментов.
• Что такое энергия активации, константа диссоциации фермент-субстратного комплекса, явление насыщения, константа Михаэлиса, уравнение Лайнуивера-Бэрка.
• Перечислите основные свойства ферментов.
• Что такое относительная и абсолютная специфичность ферментов?
• Приведите примеры стереохимической специфичности.
• Каковы типы ингибирования ферментов?
• Дайте определение понятиям: индуцированный синтез ферментов, конститутивные ферменты, летальный синтез, проферменты (зимогены), ингибирование по принципу обратной связи, ретроингибирование, активация предшественником, компартментализация.
• Как рассчитать удельную активность фермента, молекулярную активность фермента?
• Какова международная классификация ферментов?
• Перечислите основные направления медицинской энзимологии.
• Дайте определение понятию «Липиды».
• Какова классификация липидов?
• Перечислите функции липидов.
• Дайте определение понятиям: «Жирная кислота», «Высшая жирная кислота».
• Приведите примеры диеновых и и триеновых жирных кислот.
• Составьте формулу тетраеновой жирной кислоты.
• Составьте формулу триацилглицерола (ТАГ) с остатком олеиновой, линолевой и пальмитиновой кислот.
• Напишите пример формулы липида из класса «Воски».
• Составьте общий план строения фосфолипидов.
• Составьте общий план строения сфинголипидов.
• Перечислите биологические функции глицерофосфолипидов.
• Перечислите биологические функции сфингофосфолипидов.
• Составьте формулу липида с остатком N-ацетилнейраминовой кислоты, дайте ему название.
• Перечислите стероидные соединения. Что является признаком стероидных соединений?
• Составьте формулу холестерина и дайте характеристику этому соединению.
• Составьте формулу желчной кислоты и её коньюгата, объясните биологическую роль желчных кислот.
• Дайте определение понятию «Витамины». Какова классификация витаминов?
• Перечислите методы определения витаминов в биожидкостях.
• Дайте характеристику витамину «Аскорбиновая кислота». Какими методами можно обнаружит этот витамин в биологических объектах?
• Дайте характеристику витамину «Тиамин» (строение витамина а кофермента, биологические функции, признаки авитаминозов, особенности применения в медицине).
• Опишите особенности химической структуры и биологические свойства рибофлавина.
• Опишите особенности химической структуры и биологические свойства цианокобаламина.
• Составьте описание особенностей структуры, биологической активности и признаков гипо- и авитаминоза для ретинола.
• Составьте описание особенностей структуры, биологической активности и признаков гипо- и авитаминоза для кальциферола.
• Составьте формулу НАД и покажите его переход из окисленной формы в восстановленную.
• Составьте формулу ФАД и покажите его переход из окисленной формы в восстановленную.
• Перечислите витаминоподобные соединения.
• Назовите известные вам антивитамины.
• Какова биологическая роль нижеперечисленных соединений: ПАБК, пангамовая кислота, инозитол, убихинон, S-метилметионин, липоевая кислот, холин
• Какова классификация гормонов?
• Дайте характеристику гормонов гипоталамуса.
• Дайте характеристику гормонов гипофиза.
• Дайте характеристику гормонов паращитовидных желез.
• Дайте характеристику гормонов щитовидной железы.
• Дайте характеристику гормонов поджелудочной железы.
• Дайте характеристику гормонов надпочечников.
• Дайте характеристику женских половых гормонов.
• Дайте характеристику мужских половых гормонов.
• Опишите структуру и биологические свойства простагландинов.
• Опишите аденилатциклазную мессенджерную систему.
• Опишите гуанилатциклазную мессенджерную систему.
• Опишите Ca2+– мессенджерную систему.
• Опишите механизм действия на клетку адреналина.
• Опишите механизм действия на клетку инсулина.
• Опишите механизм действия на клетку тестостерона.
• Опишите типичное проявление авитаминоза (по выбору).
• Опишите типичное проявление гипофункции железы (по выбору).
• Опишите типичное проявление гиперфункции железы (по выбору).
• Что такое эйкозаноиды?
• Объясните биологические эффекты простагландинов, лейкотриенов и тромбоксанов.
Ситуационные задачи с развёрнутым ответом
Примеры задач с решением:1. В лаборатории из токсина змей выделен трипептид, Установлено, что он состоит из трех незаменимых аминокислот, одна из которых серосодержащая со свободной сульфгидрильной группой, другая – гетероциклическая, производное индола, а третья – гидроксилсодержащая. Предложите химический состав этого трипептида.
Решение: Метионин-триптофан-треонин
2. Проводя химический анализ сывороточного белка альбумина, учеными было установлено, что в составе содержится 0,58 % аминокислоты триптофан (Трп), молекулярная масса белка составляет 204 г/моль. Рассчитайте минимальную молекулярную массу белка альбумина.
Решение: Молекулярная масса альбумина = 204/ 0,0058= 35172 г/моль.
3. Известно, что фермент уреаза, расщепляющий мочевину, повышает скорость гидролиза мочевины при рН 8,0 и 20 °С в 1014 раз. Если данное количество уреазы полностью гидролизует данное количество мочевины за 5 минут, то, рассчитайте, сколько времени потребуется на гидролиз без уреазы?
Решение: 5 × 1014 минут
4. Определите класс ферментов по схемам химических реакций, напишите номер класса по международной классификации ферментов:
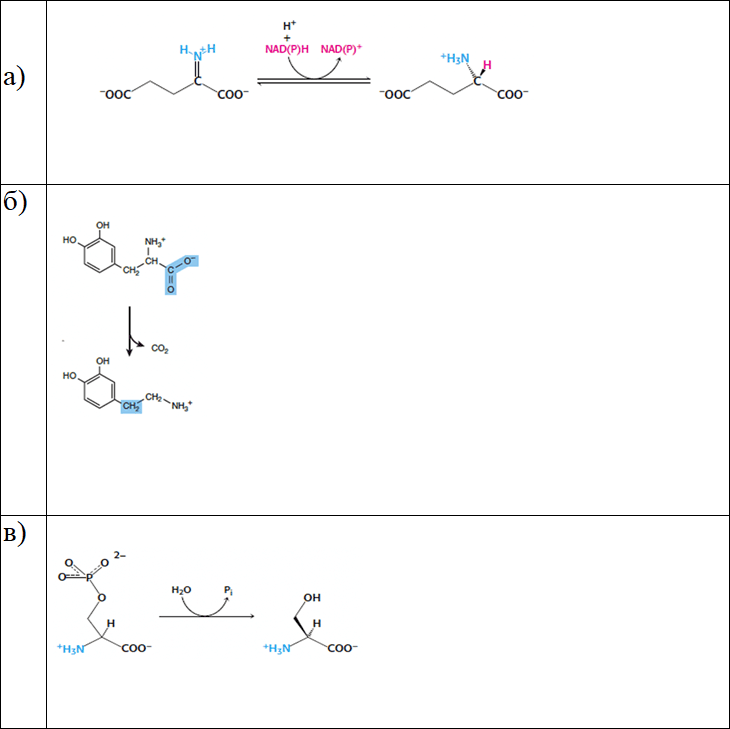
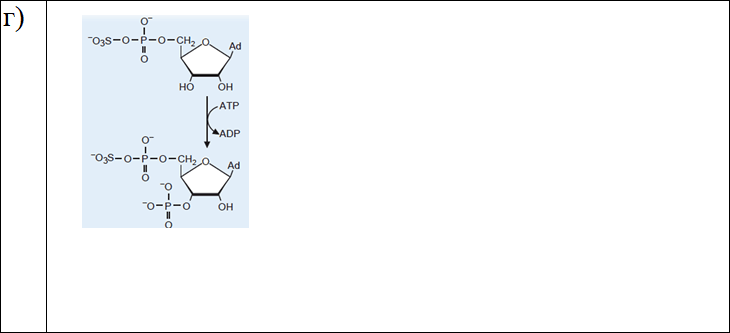
Ответы: а) оксидоредуктазы (1 класс); б) лиазы (4 класс); в) гидролазы (3 класс); г) трансферазы (2 класс).
5. При обследовании женщины в последний триместр беременности выяснилось, что у нее появились боли в костях. Биохимический анализ крови выявил увеличение содержания кальция, снижение концентрации фосфора и повышенную активность фермента щелочная фосфатаза. Предположите, о нарушениях какого витамина указывает данная клиническая картина? Какое лечение должен назначить женщине акушер-гинеколог? Профилактику какой патологии должен проводить (особенно тщательно) педиатр у ребенка этой женщины после родов?