
Вирусы и эпидемии в истории мира. Прошлое, настоящее и будущее
Главными силами в сражении с вирусами являются антитела и T-лимфоциты. Для борьбы с вирусами оспы, кори, желтой лихорадки, полиомиелита, геморрагической лихорадки и гриппа антитела, CD4+ Т-клетки и цитотоксические CD8+ T-лимфоциты генерируют специфическую иммунную реакцию на вирусные антигены, очищая хозяйский организм от инфицирующего его вируса и уничтожая инфекцию в организме выживших. Таким образом, и антитела, и T-клетки участвуют в иммунном ответе инфицируемого хозяина на конкретный вирус.
Четко определить, кто победит в гонке между вирусом и организмом-хозяином, часто можно менее, чем за 10–14 дней. Если побеждает иммунный ответ, вирусы элиминированы и инфицированный субъект выживает, часто получив стойкий иммунитет к данному вирусу. Однако если иммунная системаповержена, острая фаза заболевания либо приводит к смерти хозяина, либо переходит в устойчивую хроническую форму. Во время хронической устойчивой инфекции сроки заболевания увеличиваются и непрерывная репликация вируса может продолжаться, несмотря на реакцию иммунной системы, которая в данной ситуации по определению не положила и уже не может положить конец инфекции или ликвидировать вирус. В отличие от относительно короткого протекания острой формы инфекционного заболевания, этот долгосрочный сценарий разыгрывается, например, при ВИЧ и гепатитных инфекциях.
Инфекция ВИЧ развивается следующим образом: вскоре после того, как она проникает в хозяйскую клетку и реплицирует там, цитотоксические CD8+ T-лимфоциты генерируют мощный иммунный ответ; эта реакция коррелирует непосредственно с уменьшением вирусной нагрузки на инфицируемый организм. Производятся также и антитела, нейтрализующие инфекцию, хотя, как и при многих инфекционных заболеваниях, эта иммунная реакция появляется большей частью только после снижения вирусной нагрузки. Ключевым словом здесь является «снижение», но не полная элиминация, так как даже объединенные энергичные усилия CTL и антител не в состоянии прекратить ВИЧ-инфекцию. Вместо этого, анти-ВИЧ лимфоциты, так же, как и анти-ВИЧ антитела, теперь сосуществуют с вирусом. На поздней стадии ВИЧ-инфекции цитотоксические лимфоциты, направленные против ВИЧ, теряют свою эффективность, вирусная нагрузка на организм увеличивается, и пациент оказывается на пороге смерти. Значительное снижение активности этих лимфоцитов на поздней стадии ВИЧ-инфекции происходит, скорее всего, из-за увеличивающейся потери клеток-помощников CD4+ T-лимфоцитов. Эти клетки необходимы для поддержания активности CTL продолжительное время. Помимо всего вышеперечисленного, снижение активности лимфоцитов происходит из-за появления новых штаммов вируса, которые им не удается распознать. В противовес хроническим, острые инфекции провоцируют мощную реакцию иммунной системы, при которой лимфоциты и антитела удаляют из организма вирус полностью.
Вакцинация – это медицинская стратегия, призванная стимулировать иммунную систему на защиту от конкретного болезнетворного микроорганизма до столкновения с этой инфекцией в реальной жизни. В действительности она подготавливает составляющие иммунной системы к немедленному запрограммированному ответу на вирусную инфекцию, когда организм хозяина впервые ей подвергнется1. Провокация реакции иммунной системы таким способом до возникновения настоящей вирусной инфекции создает своего рода «проект» иммунологической памяти, так что клетки, участвующие в потенциальном антивирусном иммунном ответе, стимулированы и находятся в боевой готовности. При столкновении с полноценным инфекционным вирусом эти простимулированные клетки реагируют на него быстро и с бо́льшей интенсивностью, чем клетки не простимулированные, усиливая этим способность хозяина бороться с инфекцией и контролировать ее.
Исторически разработка противовирусных вакцин проходила по трем направлениям. Первый путь использует «живые» вирусы». Их приготавливают, пропуская вирусы через лабораторных животных (вводя их путем инъекций в организм подопытных животных, а затем снова выделяя) и тканевые культуры, или только культуры клеток, что снижает патогенность вируса для человека. Этот процесс, известный как аттенуация (ослабление), приводит к появлению нового штамма вируса с достаточным потенциалом для того, чтобы вызвать реакцию иммунной системы, но не болезнь. Ослабленный вирус затем проверяется на подопытных животных, а после этого – на волонтерах, чтобы убедиться в его безопасности и способности создавать иммунитет, то есть эффективности. Такой метод был использован при успешной разработке действенных вакцин против оспы, кори, желтой лихорадки и вакцины Сейбина от полиомиелита. Второй путь – это подавление активности опасного вируса, по сути его убийство, при помощи какого-нибудь химиката, например формалина. Затем убитый вирус проверяют на способность вызывать иммунный ответ. Вакцина Солка от вируса полиомиелита – удачный пример такого подхода. Третья опция – создание вирусной субъединицы, рекомбинанта, или ДНК-вакцины. Удачным примером такой вакцины является рекомбинантная вакцина против гепатита B; другие субъединицы и ДНК-вакцины в настоящее время подвергаются экспериментальной проверке.
Клетки реагируют на живые и убитые вирусы по-разному. Преобразование вирусных антигенов клетками идет двумя различными путями, а именно MHC I класса и MHC II класса1. При использовании пути I класса антигены живых реплицирующих вирусов (опасных, вирулентных, или ослабленных) разбиваются внутри клеток на пептиды. В соответствии с несколькими физико-химическими параметрами некоторые из этих антигенных пептидов прикрепляются к бороздкам внутри гликопротеинов хозяйского MHC I класса, затем переносятся на поверхность клеток и ждут там, когда их распознают CTL T-лимфоциты, реагирующие при помощи CD8-рецепторов. При использовании второго пути, II класса, клетки главным образом имеют дело с антигенами, изначально находящимися снаружи. Эти антигены (обычно убитые вирусы или токсины) проникают в клетку посредством фагоцитоза (эндоцитоза), и антиген разбивается на пептиды внутри везикул (наполненных жидкостью пузырьков), где они затем прикрепляются к гликопротеинам хозяйского MHC II класса. Этот комплекс затем представляется на поверхности клетки в ожидании распознавания, в основном, CD4+ T-клетками. Подводя итог, место, где происходит процессинг антигена, является ключевым моментом. Вирусные гены, синтезируемые внутри клеток, присоединяются к белкам MHC I класса, в то время как те, что захватываются снаружи клеток, прикрепляются к белкам MHC II класса. Эта классификация небезупречна из-за процесса, называемого примированием перекрестно-реагирующим антигеном, но в качестве обобщающей она достаточно точна. Вакцины, приготовленные на основе убитых вирусов, не всегда вызывают активную реакцию CD8+ T-клеток, а иммунитет, полученный с их помощью, не настолько длителен и стоек, как от вакцин на базе ослабленных живых вирусов.
Что представляют собой CD8+ и CD4+ T-клетки? Литера Т означает, что они выделены из тимуса, а обозначения CD8+ или CD4+ указывают на определенные молекулы на поверхности клеток. Лимфоциты, рожденные в костном мозге (кроветворные стволовые клетки), переносятся к тимусу и проникают в него. Внутри железы они получают «иммунное обучение» (созревают), затем проходят отбор и становятся либо клетками CD8+, либо CD4+. (Термины «T-клетки» и «T-лимфоциты» взаимозаменяемы.) Клетки CD8+ функционируют как клетки-наблюдатели и клетки-убийцы, отсюда и их название «цитотоксические T-лимфоциты» (CTL). Они путешествуют по кровеносным сосудам и странствуют среди тканей по всему телу, выискивая чужеродные (не свои) клетки, с представленными вирусными белками на поверхности или подвергшиеся раковой трансформации. Обнаружив такие клетки, CD8+ T-лимфоциты атакуют и уничтожают их. CD8+ T-лимфоциты также испускают цитокины, такие, как интерферон-гамма (IFN-гамма) и фактор некроза опухолей альфа (ФНО-альфа), которые, обладая антивирусным действием, зараженные вирусом клетки не убивают1. T-клетки CD4+ обычно играют другую роль: они высвобождают белки, которые помогают произведенным в костном мозге (но не получившим в тимусе иммунного «обучения») В-лимфоцитам дифференцироваться и производить антитела. CD4+ T-лимфоциты также помогают CD8+ T-лимфоцитам и макрофагам в выборе их назначения1,6–14. Вдобавок CD4+ T-клетки выделяют цитокины, которые тоже участвуют в избавлении от вирусной инфекции1,2. В некоторых случаях CD4+ T-клетки могут участвовать в уничтожении инфицированных вирусом клеток.
T-лимфоциты используют свои рецепторы на поверхности клетки для взаимодействия с белковыми фрагментами или пептидами вирусных антигенов, прикрепленными к MHC на поверхности инфицированных клеток. Эти белки MHC в действительности переносят вирусные пептиды на поверхность клеток. Таким образом, T-лимфоциты ищут чужеродные антигены (в данном случае вирусные антигены – пептиды, произведенные из вирусного антигена) на поверхности зараженных клеток, на которых данный вирус паразитирует. Цитотоксические T-клетки, опознав инфицированную клетку как «чужеродную» (содержащую вирус), активируются и немедленно уничтожают зараженную клетку и/или высвобождают хемокины и цитокины, предупреждающие об опасности и вооружающие другие клетки организма хозяина на борьбу с вирусом. Кроме того, некоторые из этих цитокинов способны непосредственно препятствовать репликации вирусов. Такими средствами распространение вируса ингибируется, и очаг инфекции ликвидируется.
Иммунный ответ антител и цитотоксических T-клеток зависит от количества лимфоцитов, которые производятся кроветворными стволовыми клетками во время процесса образования крови. Антитела и CTL представляют две составляющие специфических реакций иммунной системы на антигены; оба они играют важную роль в борьбе с инфекцией. На самом деле вся иммунная система обладает врожденной гибкостью, благодаря которой соответствующий вклад каждой из ее составляющих варьируется в зависимости от природы инфицирующего вируса. Антитела в основном воздействуют на вирусы в жидкостных средах тела, и, соответственно, наиболее эффективно ограничивают их распространение в крови или цереброспинальных жидкостях, которые омывают головной и спинной мозг. Посредством этого антитела уменьшают содержание вирусов и снижают их способность инфицировать клетки, а следовательно, и количество зараженных клеток. Однако уничтожение инфицированных вирусом клеток и их удаление из организма – дело главным образом CTL. Расправляясь с инфицированными клетками, T-лимфоциты ликвидируют производство вирусного потомства. По мере того, как число вирионов сокращается, работа антител становится проще.
Прежде чем продолжить рассказ о T-лимфоцитах, я сделаю отступление, чтобы описать антитела, которые являются большими белковыми молекулами. Антитела производятся В-лимфоцитами, названными так из-за их источника – костного мозга1,2. В-клетки – это малые лимфоциты, находящиеся в состоянии покоя, с ядром, которое практически заполняет всю клетку; цитоплазмы в них незначительное количество. Когда вирус или вирусный антиген встречается со специфическим лимфоцитом с заранее подготовленным рецептором для антитела, которое соответствует белковой структуре вируса, В-лимфоцит получает стимул к делению, и количество цитоплазмы, заполняющей объем клетки, увеличивается, то есть В-лимфоцит дифференцировался в плазматическую клетку. В увеличившейся в объеме цитоплазме начинают производиться и немедленно отправляться в бой антитела, сконструированные для воздействия на тот самый вирус, который дал толчок к их секреции. Один-единственный В-лимфоцит в состоянии выпустить 100 миллионов антивирусных антител в час.
Антитела захватывают и нейтрализуют вирусы, используя один из нескольких механизмов1,16:
1) антитела могут предотвратить заражение, обволакивая внешний шиповидный белок вируса, который закрепляется на рецепторе клетки и дает возможность вирусу проникнуть внутрь;
2) антитела могут собрать вирусы вместе, в комок, так что количество нетто инфекционных частиц сократится;
3) с помощью комплемента/подкрепления – группы белков в крови – антитела могут лизировать (разрушать) вирусы16; и
4) антитела могут воздействовать на вирусные антигены на внешней мембране инфицированной клетки, чтобы ограничить производство или транскрипцию вирусных молекул внутри клетки, а следовательно, сократить количество создаваемых вирусов17.
Каждая молекула антитела воздействует на конкретный антиген или определенную вирусную молекулу-мишень. С помощью генов, дающих указания синтезу разнообразных антител, организм-хозяин может синтезировать их миллиарды. Развитие и поддержание в рабочем состоянии антивирусных антител и T-клеток происходило для того, чтобы они действовали согласованно для сдерживания вирусных инфекций. Однако при определенных вирусных заболеваниях (корь, грипп, ВИЧ, и т. д.) основная роль ложится на T-клетки, тогда как при взаимодействии с семейством энтеровирусов (полиомиелит, вирусы Коксаки) главная роль оказывается у антител. Трансфер антител может ограничить развитие текущей инфекции, например, при ВИЧ18. Это происходит, вероятнее всего, следующим образом. Во время инфекций с высокой вирусной нагрузкой на организм-хозяин вирус истощает антивирусные T-клетки. Применение антивирусных антител снижает вирусную нагрузку, тем самым восстанавливая функционирование T-клеток (облегчение истощенного состояния). После этого функционирующие антивирусные T-клетки могут уничтожить клетки-фабрики, реплицирующие вирус.
Теперь, возвращаясь к T-клеткам, следует отметить, что CD4+ T-лимфоциты в некоторых особых случаях также действуют как цитотоксические клетки. И наоборот, хотя их основная роль – распознавать и уничтожать зараженные вирусом клетки, CD8+-клетки могут высвобождать растворимые молекулы, поэтому они обладают функцией хелперов/индукторов. В тканевой культуре одна клетка CD8+ T-лимфоцита может убить до 10 и даже больше инфицированных вирусом клеток, захватив зараженную клетку и растворив ее, а затем, перейдя к следующей инфицированной клетке, повторить процесс и т. д. (Рисунок 3.1.) Далее в организме живых подопытных животных один CD8+ T-лимфоцит, как показало наблюдение, единовременно связывал и разрушал до трех зараженных клеток-мишеней19. При этом очень важно то, что эти T-лимфоциты могут распознавать вирусные пептиды на инфицированных клетках прежде, чем закончится сборка вируса, и эффективно и быстро уничтожать эти клетки до образования вирионов.
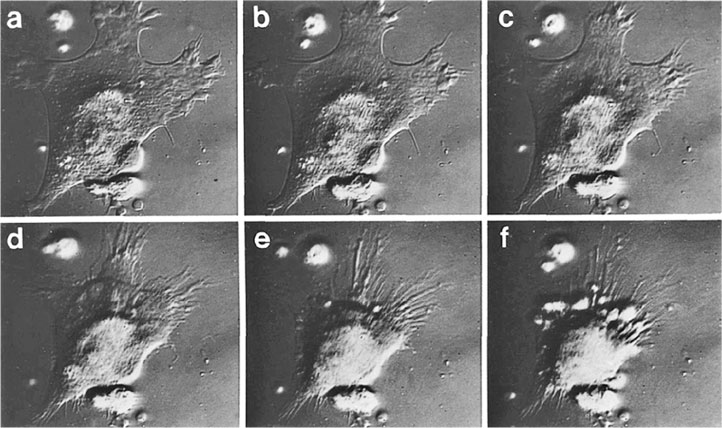
РИСУНОК 3.1. Стадии уничтожения инфицированной вирусом клетки Т-лимфоцитами (a – c): (а) стрелка указывает на Т-лимфоцит, прикрепившийся к зараженной клетке; (с) инфицированная вирусом клетка сжалась, на ней появились волдыри или вздутия, и она погибла. Все эти стадии проходят менее, чем за две минуты. Бар, 14 мк; (d – f) прикрепление Т-лимфоцита к клетке-мишени, которую лимфоциты уничтожить не могут. Продолжительность всего процесса от (d) до (f) – более 30 минут. Бар, 8 мк. Микрофотография Клауса Хана и Майкла Б. А. Олдстоуна.
Когда организм впервые сталкивается с инфицирующим его вирусом или подвергается воздействию вакцины, содержащей вирусные антигены, он генерирует специфические антитела, а также цитотоксические лимфоциты, реагирующие именно на этот вирус. (Рисунок 3.2.) Реакция CTL-лимфоцитов начинается в первый день заражения и увеличивается в 105–106 раз посредством удвоения примерно каждые 12 часов; пик роста достигается на седьмой-восьмой день после заражения.
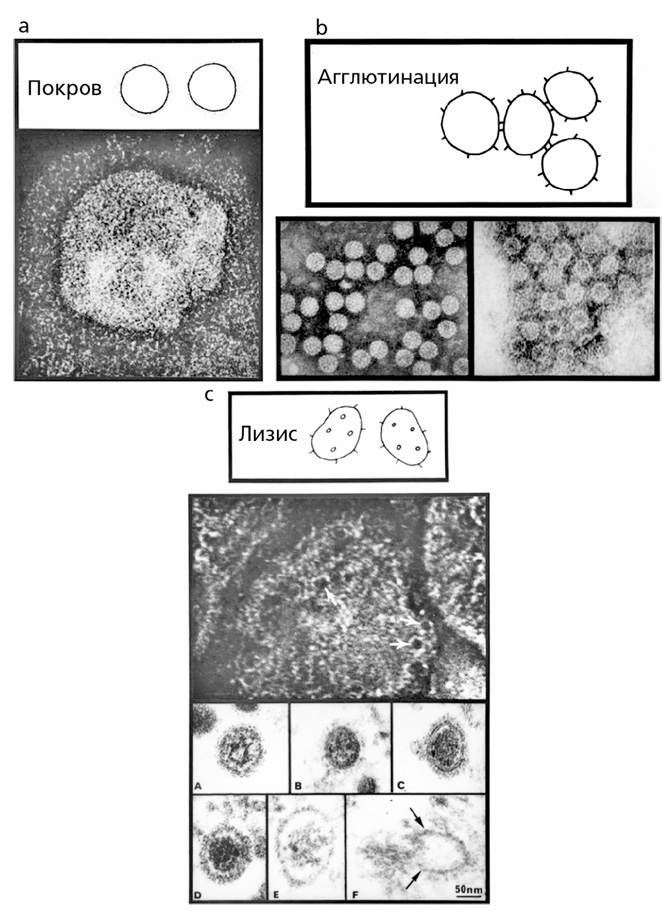
РИСУНОК 3.2. С помощью дополнительных белков (протеинов) в крови или без них антитела могут обволакивать вирусы: (а) антитело воздействует на коронавирус, собирая вирусные части вместе в один ком; (в) антитело при помощи комплементарных агентов немедленно разрушает вирус; (с, вверху) ретровирус, (с, внизу) аренавирус. В процессе разрушения ретровируса в нем образуются дыры (стрелки на рисунке), однако лизис (разрушение/растворение) аренавируса запускает цепочку событий, которые в конечном итоге приводят к выходу вирусных нуклеиновых кислот во внешнее по отношению к вирусу пространство и за пределы защитной вирусной оболочки. Микрофотография из лаборатории Майкла Б. А. Олдстоуна
После этого количество клеток сокращается и удерживается на уровне 1–2 % всех генерируемых; такие клетки превращаются в клетки иммунной памяти1,11–13. Пик реакции антител наступает после реакции CTL-лимфоцитов, и чаще всего наиболее действенные антитела, нейтрализующие вирус, появляются на поздней стадии инфекции, обычно после того, как распространение вируса уже ограничено. Тем не менее сейчас такие антитела, особенно те, которые обладают широким диапазоном нейтрализующего вирусы действия (антитела широкого диапазона реагирования), представляют интерес из-за вирусных структур, которые они узнают. Для создания вакцин, предотвращающих начало инфекций, возбудителями которых являются быстро мутирующие и образующие квазивиды вирусы, нужна генерация антител с широким диапазоном нейтрализации. Примерами таких вирусов являются ВИЧ, против которого вакцины еще нет, и грипп, вакцины от которого эффективны лишь на 70 % или менее того20,21. Важно отметить, что при помощи молекулярных технологий можно создавать антитела in vitro (лат. «в пробирке»), используя библиотеки бактериофагов22. Несвязанные или свободные антитела сложно обнаружить во время острой фазы заболевания: их количество возрастает в течение двух-четырех недель после заражения, и они остаются в организме годами. В-клетки, так же как и T-клетки, могут становиться клетками иммунной памяти, те из них, конечно, которые побывали в контакте с конкретным вирусом. Такие CD8+ T-лимфоциты и B-клетки иммунной памяти (или их антитела) часто существуют на протяжении всей жизни организма-хозяина и защищают его от повторного инфицирования тем же вирусом1,23–27. Такое происходит в организме поправившихся после вирусной инфекции оспы, кори, желтой лихорадки, полиомиелита или геморрагической лихорадки.
Когда вирусная инфекция, такая как ВИЧ, затягивается, значит иммунный ответ не справился с ликвидацией вируса. Гены, которыми обладают все вирусы, несут одну из двух главных функций. Одна группа генов гарантирует репликацию вирусного потомства. Она кодирует белки, защищающие вирусы от жестких тяжелых условий при переносе от одного организма-хозяина к другому; иными словами, геены защищают вирус, когда он проходит через внешнюю окружающую среду. Кодируются также вирусные белки, которые связывают вирус с рецепторами на клетках, способствуют проникновению вируса внутрь клетки, обеспечивают соответствующее оповещение его к началу репликации, сборки и выходу вирусного потомства из клетки, на которой он паразитирует. Среди главных целей второй группы генов – модуляция иммунной системы организма-хозяина. С помощью таких методов вирус может манипулировать нормальной работой иммунной системы, чтобы избежать отслеживания и уничтожения как его самого, так и инфицируемых им клеток. Результатом становится устойчивость существования вирусов в живом организме-хозяине.
Прорывом в изучении иммунной реакции на вирусы, инфицирующие только человека, при котором используется экспериментальная мышиная модель, стало создание человеческой иммунной системы в организме мыши – так называемой очеловеченной (гуманизированной) мыши. Такие гуманизированные мыши могут дать ответы на вопросы, необходимые для изучения человеческого организма (например, использование такого вируса, как ВИЧ, для инфицирования человека) и на которые нельзя ответить при помощи других экспериментальных моделей. Организм таких лабораторных мышей подвергается генетической манипуляции, в результате которой их иммунная система перестает вырабатывать мышиные T- и В-клетки. А затем им трансплантируют эмбриональную иммунную систему человека28.
Часть II. История успеха
Глава четвертая. Оспа: влияние на геополитику
Оспа, убившая почти 300 миллионов людей только в XX веке, – в три раза больше, чем погибло за все войны этого века, – наконец уничтожена1,2. Это глава о болезни, наводившей страх на весь мир, о ее ликвидации и о том, может ли она вернуться и снова вызвать смуту и разорение. Вот два самых интересных комментария к этому крупному достижению человечества в избавлении нашей планеты от оспы: во-первых, как 200 лет назад, так и в недавнем прошлом на пути к ее искоренению возникало значительное сопротивление; во-вторых, существуют серьезные разногласия по поводу возможности возвращения оспы и по поводу того, что следует предпринять в таком случае.
11 сентября 2001 года изменило Америку и весь мир. Заговор с целью намеренно направить два коммерческих самолета на столкновение с башнями-близнецами Всемирного торгового центра на Манхэттене указал всем странам земного шара на их уязвимость перед фанатиками, ценящими смерть дороже жизни и не считающимися с ни в чем не повинным гражданским населением. Еще раньше были устроены взрывы террористами-смертниками, и этот сценарий продолжает разыгрываться на Ближнем Востоке, в Африке, Азии и Европе.
С пониманием того, что нападения террористов-смертников могут стать причиной гибели большого числа людей, пришел страх перед биологическим терроризмом. Из нескольких имеющихся биологических возбудителей инфекции вирус оспы стоит если не наверху списка, то близко к его началу. Этот вирус прошел полевые испытания и доказал свою эффективность еще в конце 1700-х годов в битвах между французами и англичанами, известных в США как Война между французами и индейцами; затем во время Американской революции (Войны за независимость); и еще позднее – во Вторую мировую войну1–7. Во время Второй мировой войны вирус оспы применялся получившим дурную славу специальным японским отрядом № 731 в секретном центре исследования биологического оружия в поселке Пинфан. Испытания проводились на китайском и маньчжурском гражданском населении, а также на пленных солдатах8[6]: узников заражали вирусом через аэрозольные распылительные системы. Плоды этих жутких исследований попали в руки победоносным русским и американским войскам, когда каждая из сторон разрабатывала собственную программу ведения биологической войны. В 1960-х годах, в правление Никсона, исследования возможности использовать биологическое оружие в наступательных целях были прекращены США в одностороннем порядке. Тем не менее во время испытаний показательные, но относительно безвредные бактерии распылялись над выбранными городами и в метрополитене Нью-Йорка. Таким образом, технология для распыления вируса была готова, но намерения применить ее на практике не было. Русская программа ведения биологической войны все же продолжала тайно разрабатываться на протяжении всей холодной войны и до конца 1980-х годов. Основанием для этого частично была потенциальная польза биологических реагентов для проведения терактов или ведения войны, а частично – подозрения Советского Союза, что США тайно продолжают развивать свою программу биологической войны. Теракты 11 сентября, однако, превратили секретные программы испытаний в весьма реальную возможность того, что вирус оспы может стать оружием в руках террористов или нечистоплотных стран.
Когда биологический агент начинают рассматривать как оружие, в первую очередь исследуется его вирулентность: она указывает на способность микроба (в данном случае – вируса оспы) вызывать заболевание. Факторы вирулентности зашифрованы внутри генов вируса, и современная технология позволяет ими манипулировать, чтобы увеличить силу его воздействия до такого уровня, до которого природа еще не доходила. До 11 сентября вирус оспы был известен в двух видах: оспа серьезная (мажор), от которой умирал каждый третий, и оспа малая (минор) – природный штамм оспы, от которого умирал всего один человек из 100. Вирус оспы – один из наиболее известных вирусов человека, большинство его генов сходны в обоих его вариантах. Итак, лишь малое число отличий в последовательностях генов определяет, будет количество вызванных им смертей значительным или нет. Нет никаких сомнений, что вирус оспы мажор в своей природной форме или измененный для увеличения вирулентности был бы выбран в качестве биотеррористического оружия.

