Остеопороз
Полученные к настоящему времени данные поддерживают гипотезу о наличии связанных метаболических каскадов для процессов остеопороза и кальцификации сосудов. Эти два состояния, по всей видимости, развиваются постепенно и необратимо прогрессируют с возрастом.
Таблица 6
Клинические доказательства связи между кальцификацией сосудов и риском переломов
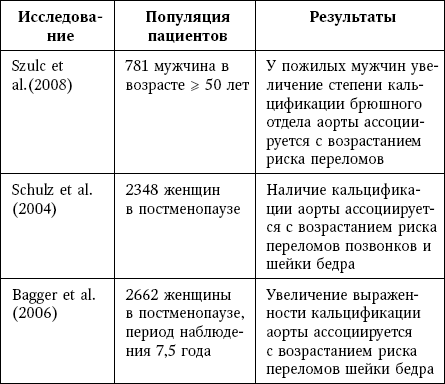

Таблица 7
Клинические доказательства связи остеопороза и сердечно-сосудистых событий
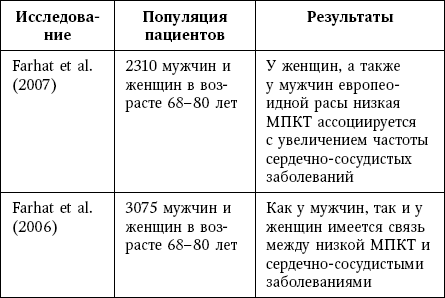
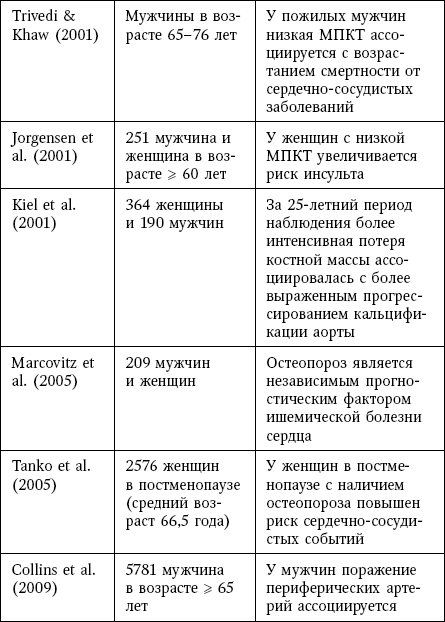
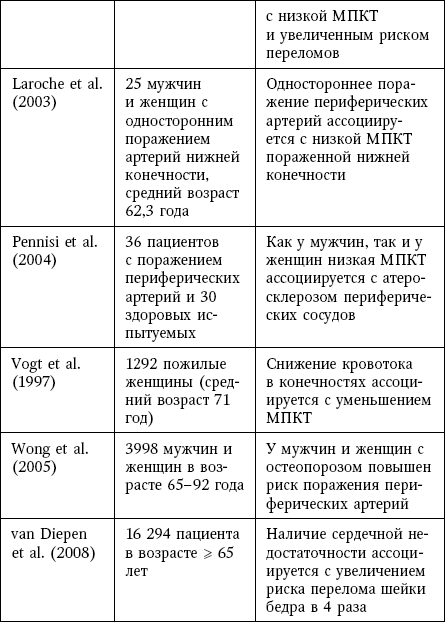
Таблица 8
Клинические доказательства связи остеопороза и кальцификации сосудов
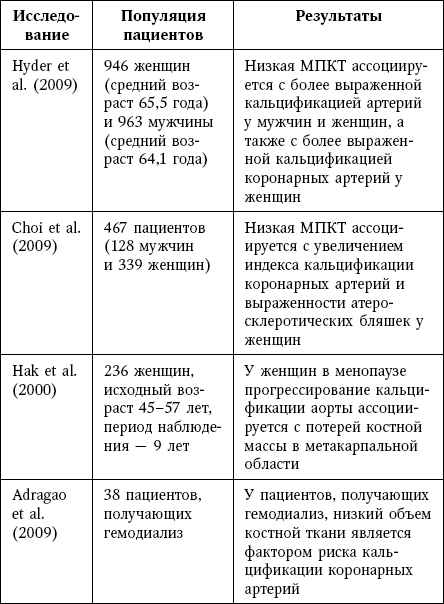
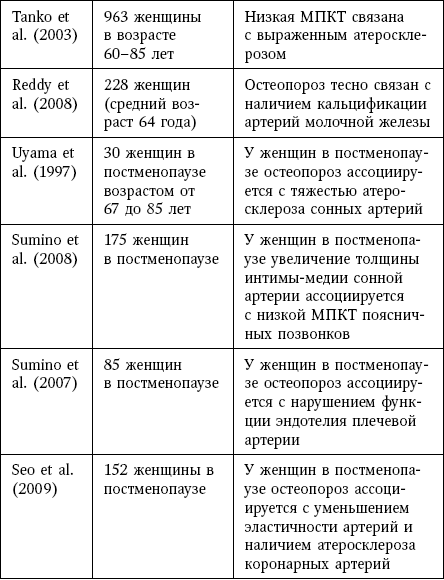
Сокращения: МПК – минеральная плотность костной ткани.
Данная связь может объясняться тем, что кальцификация сосудов, которая приводит к снижению кровотока либо к ограничению физической активности, сопровождается нарушением костного метаболизма, что, в свою очередь, ведет к потере костной массы.
В исследованиях на крысах было продемонстрировано, что бисфосфонаты в дозах, сравнимых с угнетающими костную резорбцию, подавляют кальцификацию артерий и клапанов сердца, не оказывая влияния на сывороточные концентрации кальция и фосфатов.
Этот эффект объясняется защитным действием бисфосфонатов в отношении сосудистой стенки, включая повышение чувствительности макрофагов к факторам, вызывающим апоптоз, и предупреждение образования пенных клеток посредством угнетения захвата холестерина ЛПНП.
В опытах на крысах с артериальной гипертензией бисфосфонаты тормозили развитие атеросклероза и пролиферацию ГМК сосудов. В проспективном клиническом исследовании бисфосфонаты замедляли прогрессирование атеросклеротических бляшек и увеличение индекса кальцификации брюшного отдела аорты (AAC) у женщин с остеопорозом, в то время как у здоровых женщин без лечения наблюдалось прогрессирование кальцификации сосудов; это указывает на защитный эффект бисфосфонатов в отношении атеросклероза.
В исследовании кальцификации брюшного отдела аорты MESA было показано, что, после поправки на возраст и факторы риска, более низкая МПК ассоциировалась с повышенным индексом кальцификации коронарных артерий у женщин, а также у пациентов обоих полов с повышенным значением индекса AAC.
В другом исследовании, в котором выполнялось изучение коронарных артерий методом мультиспиральной компьютерной томографии, была установлена связь индекса кальцификации коронарных артерий и выраженности атеросклеротических бляшек с низкой МПК у женщин в пре– и постменопаузе; данная связь не зависела от возраста и сердечно-сосудистых факторов риска. В исследовании продолжительностью 9 лет, которое включало 236 женщин, потеря костной массы в период менопаузы была значимо выше у женщин с прогрессированием кальцификации аорты по сравнению с отсутствием прогрессирования.
У пациентов с почечной недостаточностью, получавших гемодиализ, была установлена статистически значимая отрицательная корреляция между уровнем ремоделирования кости, который определялся в образцах, полученных методом костной биопсии, и индексом кальцификации коронарных артерий.
По-видимому, у пожилых женщин низкая МПК шейки бедренной кости является маркером выраженных атеросклеротических изменений.
Во многих исследованиях была показана связь между остеопорозом и толщиной интимы-медии сонной артерии, которая является хорошо известным фактором риска сердечно-сосудистых заболеваний.
У женщин с остеопорозом наблюдалось нарушение функции эндотелия плечевой артерии по сравнению со здоровыми женщинами, что определялось на основании поток-зависимой вазодилатации после реактивной гиперемии.
Ригидность стенки артерии, которая измерялась на основании плече-лодыжечной скорости распространения пульсовой волны, ассоциировалась с остеопорозом и атеросклерозом коронарных артерий, который определялся при помощи мультиспиральной КТ.
Кроме того, в ряде клинических исследований была продемонстрирована связь между кальцификацией сосудов и риском остеопоротического перелома (таблица 3), а также между остеопорозом и сердечно-сосудистыми событиями (таблица 4).
В исследовании MINOS с участием 781 мужчины в возрасте ≥ 50 лет, в котором период наблюдения составлял 10 лет, более высокие значения AAC ассоциировалось с возрастанием риска переломов в 2–3 раза, независимо от величины МПК либо наличия падений в анамнезе.
В группе, включавшей 2348 здоровых женщин в постменопаузе, связь между выраженностью кальцификации аорты (которая определялась при помощи КТ) и потерей костной массы была статистически значимой и не зависела от возраста; кроме того, у женщин с наличием кальцификации вероятность перелома позвонков возрастала в 5 раз и перелома шейки бедра – в 3 раза по сравнению с женщинами, у которых кальцификация отсутствовала.
В популяционном когортном исследовании, которое включало 2662 здоровые женщины в постменопаузе, за период наблюдения продолжительностью 7,5 года выраженная кальцификация аорты ассоциировалась со снижением МПК и увеличением риска перелома проксимальной части бедренной кости в 2,3 раза.
Увеличение риска переломов, особенно позвонков, и скорость снижения МПК также положительно ассоциировались с прогрессированием кальцификации аорты.
У женщин с остеопорозом риск инсульта в 4,8 раза выше по сравнению с женщинами с нормальной МПК.
В другом исследовании на основании когорты Framingham у женщин со сниженной МПК наблюдалось более выраженное увеличение AAC на протяжении 25-летнего периода наблюдения. У женщин с выраженной ИБС (определяемой как сужение просвета крупного сосуда > 50 %) остеопороз, по-видимому, служил независимым прогностическим фактором данного заболевания.
В исследовании с участием 2576 женщин в постменопаузе ускоренная потеря костной массы шейки бедренной кости ассоциировалась с увеличением риска смертности от сердечно-сосудистых причин.
Была установлена независимая корреляция между МПК, повышенным риском переломов и поражением периферических артерий.
В популяционном когортном исследовании, включавшем 16 294 пациента, было показано, что сердечная недостаточность ассоциируется с факторами, которые связаны с ускоренной потерей костной массы и повышением риска переломов, в частности перелома шейки бедра (в 4 раза); этот результат не должен вызывать удивления, поскольку в большинстве случаев пациенты с сердечной недостаточностью характеризуются ограничением подвижности.
Общие патогенетические механизмы
Факторы, участвующие в патогенезе как остеопороза, так и кальцификации сосудов, включают белки, гормоны, химические элементы, липиды и витамины (табл.).
В таблице 9 суммированы общие для обоих процессов механизмы, которые обсуждаются далее.
Таблица 9
Общие патогенетические факторы для остеопороза и кальцификации сосудов
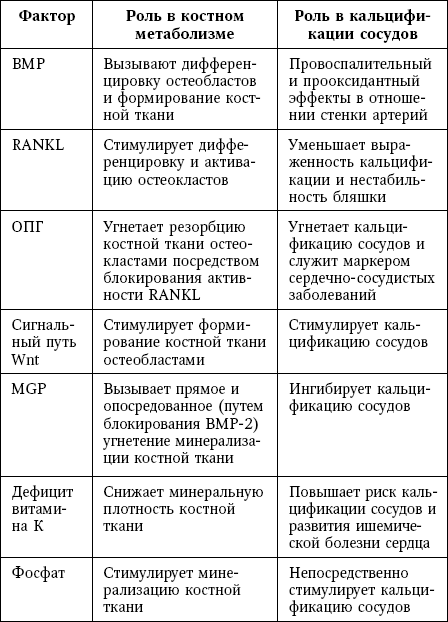
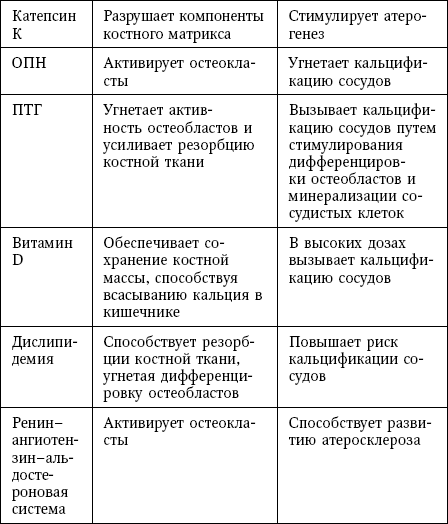
Сокращения: BMP – костный морфогенетический белок; MGP – матриксный Gla-белок; ОПГ – остеопротегерин; ОПН – остеопонтин; ПТГ – паратиреоидный гормон; RANKL – лиганд рецептора, активирующего ядерный фактор kB.
Костные морфогенетические белки (BMP)
BMP, представители суперсемейства TGF-ß, индуцируют дифференцировку мезенхимальных клеток по остеобластной линии, что сопровождается усилением синтеза коллагена. Кроме того, эти белки подавляют экспрессию коллагеназы-3 остеобластами, что приводит к уменьшению распада коллагена и сохранению костной массы.
BMP-2 вызывает дифференцировку остеобластов посредством индукции фактора транскрипции MSX2. BMP-6 опосредует стимулирующие эффекты глюкокортикоидов в отношении дифференцировки остеобластных клеток, поскольку лечение глюкокортикоидами приводит к значительному повышению концентрации мРНК BMP-6 и экспрессии данного белка.
В процессе формирования костной ткани BMP-2 и BMP-7 индуцируют экспрессию RUNX2 и Sp7; кроме того, эти белки стимулируют транскрипцию белка ноггина, который, обладая высоким сродством к BMP, связывается с ними и нейтрализует их биологические эффекты; по-видимому, этот механизм ауторегуляции ограничивает активность BMP в остеобластах.
BMP оказывают провоспалительное и прооксидантное действие в системных артериях. В исследованиях было подтверждено значительное повышение активности BMP в очагах атеросклеротических поражений. BMP-2 вырабатывается клетками сосудистого эндотелия и ГМК под влиянием провоспалительных факторов, таких как TNF и пероксид водорода.
В регуляции экспрессии BMP-2 центральную роль играет сигнальный путь NF-kB. Кроме того, активация NF-kB в эндотелии и увеличение экспрессии BMP-2 и TNF были продемонстрированы при гипергомоцистеинемии.
BMP-2 вызывает эндотелиальную дисфункцию и стимулирует выработку в эндотелиальных клетках большого количества активных форм кислорода (АФК) под действием НАДФН-оксидазы, что приводит к активации эндотелия и к усилению адгезии моноцитов.
В опытах на модели сахарного диабета у мышей было показано, что стимуляция BMP-2 and MSX2 сопровождается усилением кальцификации сосудов, а диета с высоким содержанием жиров стимулирует экспрессию MSX1 и MSX2 в периваскулярных адвентициальных клетках. BMP-4, содержание которого гораздо выше в легочных артериях по сравнению с сосудами большого круга, вызывает выраженную эндотелиальную дисфункцию системных артерий с явлениями вазоконстрикции, артериальной гипертензии и развитием атеросклеротических бляшек, в то время как легочные артерии остаются интактными. Была установлена связь стимуляции BMP-4 с развитием атеросклероза и артериальной гипертензии, тогда как прерывание сигнального пути BMP-4 ассоциировалось с развитием легочной гипертензии. Антагонисты BMP (включая фоллистатин, ноггин и MGP), которые вырабатываются в эндотелиальных клетках периферических артерий, регулируют активность BMP в сосудистой стенке. У мышей с ХБП введение BMP-7 сопровождалось значительным уменьшением кальцификации аорты и снижением гиперфосфатемии. Тем не менее размеры очагов атеросклеротических поражений не уменьшались. Введение BMP-7 приводило к снижению экспрессии остерикса.
Сигнальный путь RANKL-RANK-OPG
RANKL вырабатывается стромальными клетками и остеобластами и является ключевым фактором дифференцировки моноцитарно-макрофагальных предшественников остеокластов в многоядерные остеокласты, а также активации зрелых остеокластов.
RANKL активирует антиапоптозную серин-треониновую киназу Akt (также известную как протеинкиназа B) посредством сигнального комплекса, включающего Src-киназу и ассоциированный с рецептором TNF фактор 6 (TRAF6). Связывание RANKL с его рецептором на клетках-предшественниках остеокластов приводит к активации NFkB и NFATc1, которые необходимы для дифференцировки остеокластов. Активация NFkB происходит практически сразу, а NFATc1 – через 24–48 ч после связывания RANKL с рецептором. RANKL приводит к образованию АФК, включая ионы кислорода, свободные радикалы и пероксиды – как неорганические, так и органические, которые играют крайне важную роль в процессе остеокластогенеза. RANKL индуцирует также выработку каспазы-3 – фермента, вовлеченного в процесс апоптоза; при угнетении активности каспазы-3 остеокласты теряют способность к дифференцировке в ответ на воздействие RANKL.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Вы ознакомились с фрагментом книги.
Для бесплатного чтения открыта только часть текста.
Приобретайте полный текст книги у нашего партнера:
Всего 10 форматов