
Анализы. Полный медицинский справочник. Ключевые лабораторные исследования в одной книге
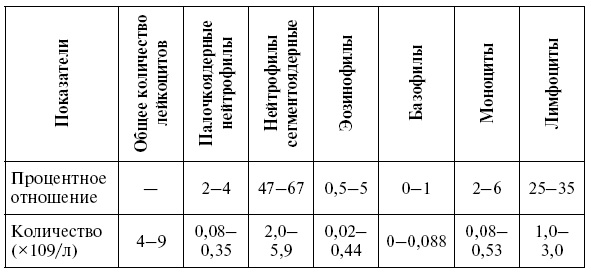
Таблица 3
Нормальная лейкограмма
Увеличение числа лейкоцитов в периферической крови выше нормального уровня называют лейкоцитозом, уменьшение – лейкопенией. Лейкоцитоз (лейкопения) редко характеризуется пропорциональным увеличением (уменьшением) числа лейкоцитов всех видов, например лейкоцитоз при сгущении крови. В большинстве случаев имеется увеличение числа (уменьшение) какого-либо одного типа клеток. Увеличение или уменьшение числа отдельных видов лейкоцитов в крови может быть относительным или абсолютным в зависимости от общего содержания лейкоцитов – нормального, повышенного или пониженного. Изменение числа, соотношения отдельных форм и морфологии лейкоцитов зависит от вида и вирулентности возбудителя, характера, течения и распространенности патологического процесса, индивидуальной реакции организма.
Изменения лейкоцитов при патологии
Количественные измененияНейтрофилез (нейтрофилия) – увеличение содержания нейтрофилов выше 6 × 109/л крови. Нейтрофильный лейкоцитоз сопровождает бактериальные инфекции, интоксикации и заболевания, протекающие с некрозом ткани. Нейтрофилез наблюдается при сепсисе, перитоните, абсцессе, остеомиелите, пневмонии и многих других воспалительных заболеваниях. Кроме этого, нейтрофилез наблюдается в результате действия гистамина, препаратов наперстянки, применения кортикостероидов, при укусах ядовитых насекомых. Иногда наблюдаются лейкемоидные реакции – изменения крови реактивного характера, напоминающие лейкозы (лейкемии) по степени увеличения числа лейкоцитов или по морфологии клеток. Лейкемоидные реакции нейтрофильного типа описаны при злокачественных опухолях, особенно с множественными метастазами в костный мозг.
Снижение содержания нейтрофилов отмечается при хронических инфекциях, облучении, вирусных заболеваниях, приеме цитостатиков, В12-дефицитных анемиях, агранулоцитозе.
Эозинофилия – повышение уровня эозинофилов крови выше 0,4 × 109/л. Эозинофилия сопутствует аллергии, внедрению чужеродных белков и других продуктов белкового происхождения. При некоторых состояниях (эндокардите Леффлера, узелковом периартериите, лимфогранулематозе) могут наблюдаться гиперэозинофильные лейкемоидные реакции, как при хроническом лейкозе (50–70% эозинофилов при количестве лейкоцитов 20–70 тыс.) с эозинофильной гиперплазией костного мозга и инфильтрацией тканей эозинофилами. Понижение числа эозинофилов может наблюдаться при воздействии кортикостероидов, адреналина, никотиновой кислоты, после приема антибиотиков, сульфаниламидных препаратов.
Базофилия – увеличение содержания базофилов в периферической крови, наиболее часто встречается при хроническом миелолейкозе и эритремии, а также при хроническом язвенном колите, некоторых кожных поражениях, при аллергических состояниях, заболеваниях системы крови, воспалительных процессах в печени, при длительном облучении малыми дозами радиации, сахарном диабете, в начале месячных у женщин.
Снижение количества базофилов отмечается при применении лучевой терапии, при острых лейкозах.
Моноцитоз – увеличение числа моноцитов выше 1,0 × 109/ л крови у взрослого. Моноцитоз является признаком хронического моноцитарного лейкоза. При легочном туберкулезе моноцитоз сопутствует острой фазе заболевания. Кроме этого он может наблюдаться при протозойных и вирусных инфекциях, развитии злокачественных заболеваний, инфекционном мононуклеозе.
Лимфоцитоз – увеличение содержания лимфоцитов выше 5 × 109/л крови. Лимфоцитоз сопровождает вирусные, некоторые хронические бактериальные инфекции, является характерной чертой хронического лимфолейкоза. Лейкемоидные реакции лимфатического типа отмечаются наиболее часто при инфекционном мононуклеозе, остром инфекционном лимфоцитозе, но возникают иногда при туберкулезе, сифилисе, бруцеллезе.
Он может возникать после тяжелого физического труда, в период затихания воспалительных процессов, во время месячных.
Лейкопения – уменьшение числа лейкоцитов в крови ниже 4,0 × 109/л, чаще бывает обусловлена снижением содержания нейтрофилов. Лейкопения (нейтропения) при одних инфекциях (брюшном тифе, паратифах, туляремии, некоторых вирусных инфекциях) выявляется закономерно, при других (подострый бактериальный эндокардит, инфекционный мононуклеоз, милиарный туберкулез) – в некоторых случаях. Факторы (ионизирующая радиация, бензол, цитостатические препараты), обладающие миелотоксическим действием, всегда вызывают лейкопению. Лейкопения (нейтропения) отмечается при недостаточности витамина В12 и фолиевой кислоты.
Агранулоцитоз – резкое уменьшение числа гранулоцитов в периферической крови (менее 0,75 × 109/л) вплоть до полного исчезновения, ведущее к снижению сопротивляемости организма и развитию бактериальных осложнений:
1) миелотоксический агранулоцитоз. Возникает в результате действия цитостатических факторов, зависит от их дозы и экспозиции, развивается обычно постепенно. Число лейкоцитов может падать очень резко, с нейтрофилами уменьшается содержание других лейкоцитов, ретикулоцитов. Миелотоксическому агранулоцитозу свойственно сочетание лейкопении с тромбоцитопенией и анемией, т. е. панцитопения;
2) к иммунным агранулоцитозам относят гаптеновый и аутоиммунный (при системной красной волчанке и некоторых других формах иммунной патологии), а также изоиммунный агранулоцитоз (у новорожденных, иногда после гемотрансфузий). Гаптеновый агранулоцитоз развивается обычно остро, падение числа нейтрофилов в периферической крови может произойти за несколько часов и закончиться полным их исчезновением из циркуляции. Лейкопения носит чаще более умеренный характер, причем гранулоцитопения может быть изолированной при сохранении лимфоцитов, ретикулоцитов и тромбоцитов. В костном мозге наблюдается уменьшение клеточных элементов за счет гранулоцитарного ростка, трепанат нередко оказывается достаточно клеточным.
Продолжительность агранулоцитоза разная: гаптеновый в большинстве случаев заканчивается через 1–2 недели при условии соответствующей терапии. Выход из агранулоцитоза характеризуется появлением в крови плазматических клеток, молодых гранулоцитов – метамиелоцитов и миелоцитов, моноцитов.
Аутоиммунный агранулоцитоз связывают с аутоантителами, обнаруживающимися в крови больных системной красной волчанкой и некоторыми другими заболеваниями и являющимися результатом снижения активности Т-супрессоров.
Изоиммунную нейтропению связывают с отсутствием в костном мозге зрелых гранулоцитов, отмечается иногда у новорожденных, что объясняется выработкой в организме матери антител (изоагглютининов) против лейкоцитов плода, проникновением этих антител через плаценту в кровь ребенка и разрушением гранулоцитов.
Эозинопения (менее 0,05 × 109/л) отмечается при введении аденокортикотропного гормона, при синдроме Кушинга, стрессовых ситуациях, при начальных фазах инфекционно-токсического состояния.
Лимфоцитопения (менее 1 × 109/л) у подростков и детей бывает связана с гипоплазией тимуса и сочетается с врожденной α-γ-глобулинемией, у взрослых наблюдается при лимфогранулематозе, распространенном туберкулезе лимфатических узлов, нередко наряду с нейтропенией, при системной красной волчанке, остром радиационном синдроме, при стрессе.
Снижение числа моноцитов (менее 0,09 × 109/л) имеет значение главным образом при оценке лимфоцитарно-моноцитарного соотношения при легочном туберкулезе.
Морфологические и биохимические измененияТоксическая грануляция в нейтрофилах – грубая, темно-красного цвета зернистость, содержится в нейтрофилах (сегменто-ядерных, палочкоядерных, метамиелоцитах) при тяжелых инфекциях или токсических состояниях. У здорового взрослого человека часть гранул нейтрофилов не окрашивается по Романовскому—Гимзе, но при изменении цитоплазматического окружения, что отмечается при патологии, они становятся окрашенными, как лизосомы.
Тельца Деле – овальные или вытянутые образования (включения) светло-голубого или серого цвета в цитоплазме нейтрофильных лейкоцитов, обнаруживаемые при скарлатине, пневмонии, кори, ожогах и представляющие собой участки цитоплазмы, свободные от специфических гранул и богатые РНК.
Гиперсегментация нейтрофильных лейкоцитов – наличие более пяти сегментов в ядрах нейтрофилов, может отмечаться у здоровых людей как наследственная конституционная особенность, но также характерна для макрополицитов при дефиците витамина В12 и фолиевой кислоты.
Пельгеровская семейная аномалия лейкоцитов – доминантно наследуемое нарушение созревания, характеризующееся уменьшением сегментации ядер гранулоцитов при нормальной зрелой цитоплазме. Наиболее часто зрелые нейтрофилы содержат двухсегментное или несегментированное ядро, редко – трехсегментное. Иногда форма ядра бывает округлой или вытянутой и напоминает ядра молодых нейтрофилов (палочкоядерных, мета- и миелоцитов), однако отличается от них грубым пикнотичным темноокрашенным хроматином. Обычно отмечается гетерозиготное носительство аномалии с доброкачественным течением.
Характерной чертой синдрома Чедиака—Хигаси – редкого заболевания детей и подростков с аутосомно-рецессивным типом наследования – является наличие больших цитоплазматических включений (аномальных гранул) во всех типах клеток крови, за исключением мегакариоцитов. Эти включения в нейтрофилах и моноцитах содержат миелопероксидазу, кислую фосфатазу, а в лимфоцитах – PAS-положительный материал и представляют собой, по-видимому, гигантские лизосомы.
При хронической гранулематозной болезни детей предрасположенность к повторным гнойным инфекциям и формированию гранулем в органах обусловлена наследственным метаболическим дефектом гранулоцитов (а также моноцитов и гистиоцитов), заключающимся в неспособности клеток во время фагоцитоза к респираторному взрыву (окислению глюкозы в гексозомонофосфатном шунте) и формированию перекиси водорода из-за недостаточности НАДФ-Н-оксидазы. Это ведет к нарушению внутриклеточного поглощения бактерий (стафилококков, протеев и др.), которые сами неспособны генерировать перекись водорода. Для диагностики заболевания применяют тест восстановления нитросинего тетразолия.
LE-феномен (lupus erythematosus) наблюдается в процессе инкубации периферической крови больных системной красной волчанкой (СКВ) и некоторых других заболеваний аутоиммунной природы.
Положительный LE-тест (метод ротирования крови со стеклянными бусами в модификации Е. И. Новоселовой) включает следующие морфологические образования: LE-клетки – нейтрофильный лейкоцит, содержащий фагоцитированный гомогенный ядерный материал. Ядерное тело имеет округлую форму, окрашивается в ярко-красный цвет, занимает центральную часть клетки, оттесняя собственное ядро нейтрофила к периферии, причем клетка с включением выглядит в 1,5–2 раза крупнее обычной. Истинные LE-клетки необходимо отличать от так называемых tart-клеток, обычно моноцитов с фагоцитированным ядром; свободно лежащий ядерный материал (гематоксилиновые тела) – образование ядерной природы, округлой формы и величиной с 1–2 лейкоцита, по гомогенной структуре и ярко-красной окраске сходный с телами внутри LE-клеток; «розетки» – образования из нейтрофилов, кольцом окружающие ядерное тело.
Внеклеточные ядерные (гематоксилиновые) тела и розетки рассматривают как промежуточные этапы образования LE-клеток. Формирование LE-клеток зависит от LE-фактора, содержащегося в плазме крови и других жидкостях у больных СКВ и представляющего собой антинуклеарные антитела (главным образом к нуклеопротеину, в меньшей степени к гистону и ДНК) γ-глобулиновой природы.
Взаимодействие фактора с ядром лейкоцита ведет к деполимеризации ядерного хроматина, освобождению ядерного материала из клетки и последующему фагоцитозу его нейтрофильными лейкоцитами, причем для фагоцитоза необходимо участие комплемента.
LE-клетки находят в 80% случаев СКВ, при ревматоидном артрите, активном гепатите, склеродермии и при лекарственных волчаночноподобных синдромах.
Лимфоциты
Жизненный цикл лимфоцитов
Лимфоциты являются главным клеточным элементом иммунной системы организма. В процессе лимфопоэза из общей клетки развиваются 2 класса лимфоидных клеток. Одна отделившаяся клетка мигрирует из костного мозга в тимус, где под влиянием гормоноподобного вещества – тирозина – дифференцируется в Т-клетки, поступающие затем в циркуляцию и в периферические лимфоидные органы (лимфоузлы, селезенку, миндалины, лимфоидную ткань кишечника); другая в костном мозге превращается в В-клетку, предшественники которой мигрируют в кровь и лимфатические органы. Дальнейшая дифференцировка Т-клеток в эффекторные Т-лимфоциты, в антителопродуцирующие плазматические клетки зависит от антигена. Т-лимфоциты и часть В-лимфоцитов находятся в постоянном движении по периферической крови и тканевым жидкостям. Уровень функциональной дифференцировки лимфоцитов не всегда можно определить морфологически в световом микроскопе, морфологические отличия свойственны лишь иммунобласту – бласттрансформированному под влиянием антигена лимфоциту.
Т-лимфоциты ответственны за распространение чужих антигенов, отторжение чужеродных и собственных клеток, модифицированных антигенами. Они делятся на несколько субклассов – киллеры, хелперы, эффекторы гиперчувствительности замедленного типа, супрессоры.
Система В-лимфоцитов также подразделяется на множество мелких функциональных подсистем, способных реагировать с разными антигенами. Подобная специализация (клональная селекция) обеспечивает продукцию около миллиона различных антител. На часть антигенов (тимуснезависимые) В-лимфоциты отвечают самостоятельно, на большинство других (тимусзависимые АГ) гуморальный ответ возможен при условии кооперирования В-клеток с Т-клетками (и макрофагами) и получения от Т-лимфоцитов (Т-В-хелперов) дополнительного сигнала.
При первичной встрече с антигеном антителопродуцирующие потомки В-клеток синтезируют сначала (2–4 дня после иммунизации) антитела, относящиеся к IgM, затем (4–7 день), если доза антигена большая, происходит синтез антител класса IgG и в конечной стадии – IgF. Кроме того, при первичном ответе образуется клон В-лимфоцитов, обладающий памятью. При вторичной иммунной стимуляции на большинство антигенов вырабатываются антитела класса IgG. Функциональная разнородность лимфоцитов при морфологическом сходстве затрудняет изучение их кинетики. Тем не менее радиоизотопными методами установлено существование двух популяций лимфоцитов – коротко- и долгоживущих. Продолжительность жизни первых около 4 дней, вторых – в среднем около 170 дней. Короткоживущие формы составляют около 30% всех лимфоцитов периферической крови. Большинство В-клеток принадлежат к короткоживущим, а Т-клетки (кроме Т-супрессоров) – к долгоживущим лимфоцитам.
Методы идентификации разных классов и субклассов лимфоцитов основаны на выявлении клеточных рецепторов – поверхностных мембранных структур, обладающих способностью спонтанно связывать некоторые индикаторные клетки или молекулы.
Распределение Т- и В-лимфоцитов в периферической крови человека следующее: 25–30% составляют В-клетки и 60% – Т- клетки. Лимфоциты, на которых не выявляются ни Т-рецепторы, ни В-рецепторы, названы нулевыми, содержание которых в периферической крови около 10%. Предполагают, что к нулевым клеткам принадлежат предшественники Т- и В- лимфоцитов.
Тромбоциты
Жизненный цикл тромбоцитов
Тромбоциты представляют собой фрагменты клеток мегакариоцитов, основная их функция – участие в процессе свертывания крови. Нормальное количество тромбоцитов: 180–320 × 109/л – у детей старше 10 дней, 99–421 × 109/л – у взрослых.
Одна треть вышедших из костного мозга тромбоцитов депонируется в селезенке, остальная часть циркулирует в крови.
Тромбоциты живут максимум 10–12 дней, средняя продолжительность жизни тромбоцита составляет 7 суток. Родоначальной клеткой мегакариоцитарного ряда является мегакариобласт – клетка крупного размера (20 мкм) с ядром грубой структуры, содержащим нуклеолы. Цитоплазма барофильная.
Промегакариоцит имеет тенденцию к полиморфизму ядра, цитоплазма базофильная, беззернистая.
Мегакариоцит – гигантская клетка костного мозга диаметром от 60 до 120 мкм. Ядро грубое, принимает различные, иногда причудливые, формы.
Цитоплазма отличается очень большими размерами, содержит зернистость розово-фиолетового цвета. От цитоплазмы мегакариоцита отшнуровываются тромбоциты.
Тромбоциты содержатся в периферической крови у здоровых лиц в основном в виде нормальных зрелых пластинок (90–98%) размером от 1 до 3 мкм, имеющих четкие границы, сиреневый гиаломер и центрально расположенный грануломер, состоящий из 5–20 азурофильных зерен.
Другие виды пластинок: юные (с голубоватым гиаломером и скудной зернистостью), старые (с неровными очертаниями и плотным грануломером, иногда занимающим весь тромбоцит) формы раздражения (мелкие или в виде гигантских тромбоцитов); в норме составляют лишь небольшой процент и появляются в большем количестве при патологии.
Тромбоциты – кровяные пластинки – имеют 3 структурные зоны:
1) периферическую (трехслойная мембрана, содержащая рецепторы для коллагена, АДФ, серотонина, эпинефрина, тромбина, фактора Виллебранда; на внешней стороне мембраны расположен аморфный слой из кислых мукополисахаридов и адсорбированных факторов свертывания плазмы крови);
2) зоны «золь-гель» (микротубулы-каналы, часть которых имеет выход на наружной мембране; микрофиламенты, содержащие контрактильный протеин тромбостеин, участвующий в поддержании дискообразной формы пластинок; от его свойств зависит ретракция кровяного сгустка);
3) зону органелл (гликогеновые гранулы, митохондрии, α-гранулы, плотные тела, аппарат Гольджи).
Гранулы высокой плотности содержат серотонин, адреналин (адсорбируются из плазмы через каналикулярную систему), кальций, неметаболические АДФ и АТФ, 4 фактора тромбоцитов, гранулярную часть, 3 фактора тромбоцитов; α-гранулы содержат гидролитические ферменты (кислую фосфатазу, β-глюкуронидазу, катепсины), фибриноген тромбоцитов. Тромбоциты используют энергию АТФ, образуемую в процессе гликолиза, а также в процессе фосфорилирования.
Определение количества тромбоцитов
Метод подсчета в мазке крови. В мазке крови подсчитывают количество тромбоцитов по отношению к 1 тыс. эритроцитов. Зная абсолютное число эритроцитов в 1 мкл крови, вычисляют количество кровяных пластинок в 1 мкл. Для предотвращения агглютинации кровяных пластинок на место укола наносят каплю 14%-ного раствора сульфата магния. Выделившуюся каплю крови смешивают с магнезией и из смеси готовят мазки на предметных стеклах, которые окрашивают по Романовскому—Гимзе в течение 2–3 ч. Подсчет кровяных пластинок производят под иммерсионной системой микроскопа с использованием сетчатого окуляра или вкладного окошка.
Существует метод подсчета тромбоцитов в камере, при котором кровь разводят для предотвращения свертывания и агглютинации тромбоцитов в консервирующей жидкости, например в 5–7%-ном растворе трилона Б, заполняют камеру и подсчитывают тромбоциты и эритроциты одновременно. Сосчитав 1 тыс. эритроцитов, суммируют общее количество встретившихся тромбоцитов. Зная количество эритроцитов в единице объема крови, высчитывают количество тромбоцитов для единицы объема крови.
Метод подсчета тромбоцитов на счетчике частиц. Тромбоциты можно подсчитывать на любом счетчике частиц типа «Культер» и «Целлоскоп». Венозную кровь, смешанную с антикоагулянтом (цитратом натрия), оставляют на несколько часов для оседания эритроцитов и лейкоцитов. Тромбоциты практически не оседают и остаются равномерно распределенными в плазме крови.
Плазму разводят изотоническим раствором хлорида натрия и пропускают через счетчик. Используется измерительная трубка с капиллярным отверстием для подсчета тромбоцитов (50 мкм). Затем производят второй подсчет, пользуясь измерительной трубкой с большим капиллярным отверстием для подсчета оставшихся в плазме и не осевших эритроцитов (60 мкм). Разность между результатами первого и второго подсчета показывает истинное количество тромбоцитов.
В настоящее время подсчет числа тромбоцитов производится на гематологическом анализаторе. Это повышает точность и скорость подсчета тромбоцитов. Принцип подсчета основан на кондуктометрическом методе. Обычно ход исследования излагается в инструкции к прибору.
Число тромбоцитов у здорового человека в среднем составляет 180–320 × 109/л.
Исследование адгезии тромбоцитов
Из способов изучения адгезии тромбоцитов наиболее информативными являются закрытые методы, при которых кровь прямо из вены пропускается через колонку со стеклянными бусами (диаметр 0,5 мм) с соблюдением времени контакта. По разнице количества тромбоцитов в крови до и после прохождения через колонку судят о количестве тромбоцитов, подвергшихся адгезии к стеклу.
Исследование агрегации тромбоцитов
Агрегацию тромбоцитов исследуют в обогащенной тромбоцитами плазме крови с помощью ФЭК или специальных фотометров (агрегометров) либо микроскопически – путем подсчета тромбоцитарных агрегатов и свободно лежащих тромбоцитов.
Агрегационную функцию тромбоцитов определяют при воздействии различных физиологических агрегирующих агентов: оптимальных и малых доз АДФ, коллагена (в эмульсии), адреналина, малых доз тромбина.
Кроме этих методов, применяют электронно-микроскопические (изучение ультраструктуры тромбоцитов), радиоизотопные (определение продолжительности жизни тромбоцитов), гистологические (исследование мегакариоцитов в срезах костного мозга), иммунологические (определение антитромбоцитарных антител) методы исследования.
Оптическая агрегатометрия. Прибор регистрирует изменения светопропускания плазмы, обогащенной тромбоцитами. До анализа данным методом необходимо центрифугировать образец крови для получения средней концентрации тромбоцитов 200–250 г × 109/л. Отрицательное последствие центрифугирования – возможность контактной активации тромбоцитов, а также потери части рецепторов с их поверхности. Положительная сторона – наличие одинаковой концентрации тромбоцитов, что позволяет сравнить результаты анализов у одного пациента, проведенных в разное время.
Импедансная агрегатометрия. Для анализа берут цельную кровь. Данный метод не нуждается в предварительной подготовке, получении обогащенной плазмы. В нем измеряется изменение сопротивления между двумя электродами, погруженными в цельную кровь. Данный анализ демонстрирует физиологическое состояние в крови пациента в конкретный момент забора крови. Посредством этого метода возможно выполнение значительного количества исследований за меньшее время.
Как гипоагрегация (снижение агрегационной способности тромбоцитов), так и гиперагрегация (склонность к тромбообразованию) могут быть выявлены любым из приведенных выше методов. Считается, что гипоагрегацию лучше распознает оптическая агрегатометрия, а гиперагрегацию – импедансная.
Гематологические анализаторы рисуют тромбоцитометрические кривые-гистограммы. При наличии молодых форм происходит сдвиг гистограммы вправо, старые формы располагаются слева, так как по мере старения их объем уменьшается.
Изменения тромбоцитов при патологииТромбоцитоз – увеличение числа тромбоцитов выше чем 400 × 109/л – бывает первичным (результат первичной пролиферации мегакариоцитов) и вторичным (на фоне какого-либо заболевания). Вторичный тромбоцитоз (реактивный) обычно не столь выражен, как первичный, реже осложняется тромбозом или кровотечением и исчезает при устранении причины. Он встречается при ревматической лихорадке, ревматоидном артрите, туберкулезе, циррозе печени, остеомиелите, острой кровопотере, карциноме, состоянии после спленэктомии, после операций, остром гемолизе и других заболеваниях.
Тромбоцитоз как часть миелопролиферативного синдрома (эритремии, хронического миелолейкоза, миелофиброза) может быть очень выражен (до 4–5 млн в 1 мкл крови), обычно стоек и сочетается с лейкоцитозом, а при эритремии – с эритроцитозом.
Тромбоцитопения – уменьшение числа тромбоцитов в крови – может быть значительной или умеренной, однако клинические проявления геморрагического синдрома возникают при количестве тромбоцитов 180 × 109/л.