Антитромботическая терапия в клинике внутренних болезней

Руслан Линчак
Антитромботическая терапия в клинике внутренних болезней
Автор: Линчак Руслан Михайлович – доктор медицинских наук, доцент, преподаватель кафедры терапии неотложных состояний ФГБВОУ «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ (г. Москва)
Рецензенты:
Симоненко Владимир Борисович, член-корреспондент РАН, заслуженный деятель науки РФ, заслуженный врач РФ, д.м.н., профессор, генерал-майор медицинской службы, профессор кафедры терапии неотложных состояний филиала ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ (г. Москва)
Гендлин Геннадий Ефимович, д.м.н., профессор, профессор кафедры госпитальной терапии №2 лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России (г. Москва)
Черкашин Дмитрий Викторович, д.м.н., профессор, полковник медицинской службы, начальник кафедры Военно-морской и госпитальной терапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ (г. Санкт-Петербург)
В учебном пособии представлены современные представления о физиологии систем свертывания и противосвертывания крови, классификация и характеристики основных фармакологических средств, влияющих на гемостаз, предпосылки, доказательная база и основные положения современных клинических руководств для назначения антитромботической терапии европейских и отечественных профессиональных экспертных сообществ при широком круге состояний и заболеваний (первичная кардиоваскулярная профилактика, острая и хроническая ИБС, фибрилляция предсердий, венозные тромбоэмболические осложнения, протезированные клапаны сердца, пандемия COVID-19), часто встречающихся в практике врача-интерниста.
Утверждено на заседании Ученого совета ФГБВОУ «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ протокол № 5 от «09» февраля 2021 г.
Рекомендовано Учебно-методическим советом ФГБВОУ «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ в качестве учебного пособия для обучающихся по направлению 31.08.49 «Терапия», профиль «Терапия» уровня ординатуры и для обучающихся по программам ДПО по профилю специальности «Терапия».
Список сокращений
АВК – антагонист витамина К
АВС – активированное время свертывания
АД – артериальное давление
АДФ – аденозиндифосфат
АТТ – антитромботическая терапия
АТ-III – антитромбин III
АЧТВ – активированное частичное тромбиновое время
ВТЭ – венозные тромбоэмболии
ВТЭО – венозные тромбоэмболические осложнения
ГП – гликопротеины
ДААТ – двойная антиагрегантная терапия
ДВС-синдром – синдром диссеминированного внутрисосудистого свертывания
ЖКТ – желудочно-кишечный тракт
ИБС – ишемическая болезнь сердца
ИИ – ишемический инсульт
ИМ – инфаркт миокарда
ИМбпST – инфаркт миокарда без подъема сегмента ST
ИМпST – инфаркт миокарда с подъемом сегмента ST
КТ – компьютерная томография
КШ – коронарное шунтирование
ЛЖ – левый желудочек
ЛНПГ – левая ножка пучка Гиса
ЛП – левое предсердие
МНО – международное нормализованное отношение
НМГ – низкомолекулярный гепарин
НС – нестабильная стенокардия
НФГ – нефракционированный гепарин
ОАК – оральный антикоагулянт
ОКС – острый коронарный синдром
ОКСбпST – острый коронарный синдром без стойкого подъема сегмента ST
ОКСпST – острый коронарный синдром cо стойким подъемом сегмента ST
ОНМК – острое нарушение мозгового кровообращения
ОР – относительный риск
ПДФ – продукты деградации фибриногена
ПЖ – правый желудочек
ПОАК – прямые оральные антикоагулянты
РКИ – рандомизированное клиническое исследование
ССО – сердечно-сосудистые осложнения
ТААТ – тройная антитромботическая терапия
ТГВ – тромбоз глубоких вен
ТИА – транзиторная ишемическая атака
ТЛТ – тромболитическая терапия
ТАП – тканевой активатор
ТХА2 – тромбоксан А2
ТЭЛА – тромбоэмболия легочных артерий
ФВ ЛЖ – фракция выброса левого желудочка
ФП – фибрилляция предсердий
фФВ – фактор Фон Виллебранда
ХБП – хроническая болезнь почек
ЦОГ – циклооксигеназа
ЧКВ – чрескожное коронарное вмешательство
ЧпЭхо-КГ – чреспищеводная эхокардиография
Эхо-КГ – эхокардиография
BNP – brain natriuretic peptide (мозговой натрийуретический пептид)
ESC – European society of cardiology (Европейская ассоциация кардиологов)
PESI – The Pulmonary Embolism Severity Index (шкала стратификации риска ранней смерти при тромбоэмболии легочных артерий)
PG – prostaglandin (простагландин)
t-PA – tissue plasminogen activator (тканевой активатор плазминогена)
TAVI – transcatheter aortic valve implantation (транскатетерная имплантация аортального клапана)
TTR – time in target range (время нахождения в целевом диапазоне)
Введение
Тромбоз, будучи одной из самых филогенетически древних и универсальных защитных реакций организма человека, выходя за физиологические рамки, становится причиной таких грозных клинических проявлений, как инфаркт миокарда, инсульт, тромбоэмболия легочных артерий, внезапная сердечная смерть. Широкий круг нозологий, в основе которых лежит тромбообразование того или иного органа или системы, предопределяет неизбежность встречи практически любого врача с данной проблемой и диктует необходимость профессионального управления этим процессом.
Ежегодно появляются десятки клинических руководств различных профессиональных врачебных сообществ, касающихся тромбоз-ассоциированных заболеваний, задача которых состоит в интеграции результатов появляющихся исследований и создания образовательного инструмента для их внедрения в клиническую практику. Однако многие вопросы лечения, первичной и вторичной профилактики остаются дискутабельными, не имеют единого подхода к решению, а новая информация появляется настолько быстро, что делает ряд положений устаревшими уже в скором времени после их публикации.
В данном учебном пособии мы попытались аккумулировать самые современные рекомендации различных отечественных и европейских экспертных сообществ к назначению антитромботической терапии для лечения и профилактики тромбозов при широком круге состояний и заболеваний, наиболее часто встречающихся в практике врача-интерниста, представили патогенетические предпосылки и существующие доказательства таких назначений.
Классификация рекомендаций (классы и уровни доказательности)
Глава III, посвященная антитромботической терапии у разных категорий пациентов, содержит рекомендации по назначению антитромботических препаратов, разработанные экспертами отечественных и зарубежных профессиональных врачебных сообществ в той или иной области.
В таблице 1 представлена классификация рекомендаций, включающая классы и уровни доказательности, их определение и интерпретация.
Глава первая. Основы физиологии системы свертывания и противосвертывания крови
1.1 Система свертывания (коагуляции, гемостаза)
– биологическая система, основная функция которой заключается в сохранении жидкого состояния циркулирующей крови, купировании и предупреждении кровотечений [1, 2]. Гемостаз представляет собой последовательность сложных реакций, направленных на остановку кровотечения при повреждении сосуда. Его основными взаимодействующими между собой функционально-структурными компонентами являются:
А. Стенка кровеносных сосудов;
Б. Клетки крови;
В. Плазменные ферментные факторы.
А. СТЕНКА КРОВЕНОСНЫХ СОСУДОВ.
ЭНДОТЕЛИЙ, выстилающий внутреннюю поверхность кровеносных сосудов, является аутокринным, паракринным и эндокринным органом, осуществляющим многочисленные регуляторные функции [1, 3]. Он обладает высокой тромборезистентностью и играет важную роль в поддержании жидкого состояния крови и предупреждении тромбозов. Это свойство эндотелия обеспечивается:
контактной инертностью внутренней, обращенной в просвет сосуда, поверхности этих клеток, в силу чего она не активирует систему гемостаза;
синтезом мощного ингибитора агрегации тромбоцитов – простагландина I2 (простациклин PGI2);
высоким содержанием на внутренней поверхности кровеносных сосудов мукополисахаридов и фиксацией на эндотелии комплекса «гепарин-антитромбин III»
наличием на цитоплазматической мембране эндотелиальных клеток особого гликопротеина – тромбомодулина, связывающего тромбин, благодаря чему последний утрачивает способность вызывать свертывание крови, но сохраняет активирующее действие на систему двух важнейших антикоагулянтов – протеинов С и S;
элиминацией из крови активированных факторов свертывания крови и их метаболитов;
синтезом тканевого активатора плазминогена.
Совокупная масса эндотелиальных клеток у взрослого человека составляет 1600-1900 г, что превышает массу печени. Эндотелий обладает уникальной способностью менять свой антитромботический потенциал на тромбогенный. При гибели эндотелиальных клеток обнажается субэндотелиальный слой, содержащий большое количество коллагена, в контакте с которым происходят активация, адгезия и агрегация тромбоцитов, а также активация плазменного звена свертывания крови (см. ниже). Этот процесс реализуется при участии крупномолекулярных гликопротеинов, в первую очередь, фактора Виллебранда, фибронектина и фибриногена. Важная роль указанного механизма подтверждается тем, что при генетически обусловленных дефектах субэндотелия – истончении и уменьшении коллагена в его структуре (болезнь Рендю-Ослера, мезенхимальные дисплазии), как и при дефиците фактора Виллебранда, наблюдаются профузные и длительные кровотечения из поврежденных микрососудов [2, 3, 4].
Трансформация антитромботического потенциала эндотелия в тромбогенный происходит при снижении скорости кровотока, гипоксии, повреждении стенок сосудов физическими и химическими агентами, под влиянием экзо- и эндотоксинов, среди которых главенствующую роль играют бактериальные эндотоксины, иммунные комплексы, антиэндотелиальные и антифосфолипидные антитела, медиаторы воспаления (интерлейкины, фактор некроза опухоли и др.), а также клеточные и плазменные протеазы (эластаза, трипсин, тромбин и др.). Такая же трансформация наблюдается и при метаболических изменениях сосудистой стенки (атеросклероз, диабетическая ангиопатия).
ПРОСТАЦИКЛИН (PGI2) постоянно синтезируется стенкой сосудов и выделяется в кровь, препятствует адгезии и агрегации тромбоцитов на нормальной неповрежденной эндотелиальной выстилке сосудов. Он образуется в большинстве органов и тканей человека. Легкие являются мощным генератором простациклина, который, секретируясь в кровь, функционирует как циркулирующий гормон. В артериальной крови содержание простациклина выше, чем в венозной. Помимо более высокой скорости кровотока, с этим связано менее частое тромбообразование в артериях по сравнению с венами [2].
Простациклин является продуктом ферментативного распада арахидоновой и эйкозапентаеновой кислот. Медикаментозная блокада циклооксигеназы (ЦОГ) снижает уровень простациклина, что является одним из факторов повышения сердечно-сосудистой смертности пациентов, длительно принимающих нестероидные противовоспалительные препараты, за исключением аспирина в низких дозах [3].
Физиологическая роль простациклина заключается в его способности ингибировать агрегацию и, в меньшей степени, адгезию тромбоцитов, снижать тонус гладкомышечных клеток сосудов, что сопровождается вазодилатацией и снижением системного артериального давления, а также оказывать антиаритмическое, противосклеротическое и антиульцерогенное действие.
ГЛАДКОМЫШЕЧНЫЕ КЛЕТКИ СОСУДОВ обеспечивают регуляцию сосудистого тонуса, его соответствие реологическому составу протекающей крови. Взаимосвязь между факторами, регулирующими агрегатное состояние крови и влияющими на тонус сосудов, осуществляет калликреин-кининовая система (прекалликреин, высокомолекулярный кининоген, калликреин, кинины и др.) [1, 2]. Миоциты сосудов поддерживают ламинарный поток крови в сосуде, сужение просвета вызывает турбулентность потока с последующей активацией тромбоцитов. При нарушении целостности сосудистой стенки гладкомышечные клетки сокращаются, что вызывает уменьшение/перекрытие просвета сосуда, останавливая кровотечение. Микрососуды в ответ на повреждение отвечают спазмом, капилляры и венулы временно запустевают, и кровотечение из них в первые 20-30 секунд не возникает.
БАЗАЛЬНАЯ МЕМБРАНА СОСУДА влияет на реологию крови, регулируя скорость прохождения отдельных веществ из крови в ткани и обратно [2, 3]. Поры мембраны имеют краевой заряд, отталкивающий в норме крупномолекулярные соединения, при этом альбумин за счет онкотического давления удерживает воду в кровотоке, обеспечивая необходимую вязкость крови. Нарушения гемостаза изменяют порозность базальной мембраны.
Б. КЛЕТКИ КРОВИ
ТРОМБОЦИТЫ продуцируются в органах кроветворения гигантскими полиплоидными клетками – мегакариоцитами, от цитоплазмы которых они отшнуровываются в виде округлых или овальных плоских дисков диаметром от 2 до 4 мкм. Продолжительность жизни тромбоцитов человека составляет 7-10 дней. После выхода из костного мозга они циркулируют в крови и частично депонируются в селезенке и печени (около 20-25% всех клеток), откуда происходит их вторичный выход в кровоток [3, 5].
Тромбоцит окружен двухслойной фосфолипидной мембраной, в которую встроены рецепторные гликопротеины (ГП), взаимодействующие со стимуляторами (агонистами) адгезии и агрегации этих клеток. Ключевую роль в процессе усиления агрегации и адгезии тромбоцитов играют ГП Ib, взаимодействующие с фактором Фон Виллебранда (фФВ) и коллагеном, а также ГП IIb/IIIа, связывающиеся с АДФ, адреналином и другими агонистами агрегации. В процессе активации тромбоцитов меняется форма этих клеток, они становятся вначале шарообразными с большим количеством внутриклеточных секреторных гранул. В последующем на их поверхности появляются отростки – «псевдоподии», и многократно усиливается экспрессия рецепторов Ib и IIb/IIIa. Такие тромбоциты секретируют в кровь биологически активные вещества (АДФ, серотонин, адреналин и др.), находящиеся в гранулах, что значительно способствует адгезии тромбоцитов. Возрастает способность ГП IIb/IIIа соединяться с фибриногеном с образованием между клетками фибриногеновых и фибриновых мостиков [2].
Большая роль в регуляции тромбоцитарного гемостаза принадлежит производным арахидоновой кислоты. Адгезивно-агрегационная функция тромбоцитов в значительной степени зависит от транспорта ионов кальция в эти клетки. В тромбоцитах из арахидоновой кислоты с участием ЦОГ образуется мощный стимулятор агрегации и ангиоспазма – вазоконстриктор тромбоксан А2 (ТХА2). Кроме того, ТХА2 за счет инициации тромбообразования способствует развитию атеросклеротических бляшек и увеличению размеров поражения. ТХА2 может играть также роль медиатора ишемии, которая связана с агрегацией тромбоцитов. Дисбаланс между тромбоксаном и простациклином резко усиливает агрегацию и реакцию высвобождения гранул [1].
При ряде наследственных и приобретенных тромбоцитопатий нарушение образования ТХА2 в результате снижения активности или блокады ЦОГ или тромбоксан-синтетазы ведет к выраженному нарушению функции тромбоцитов, способствует развитию кровоточивости, что наблюдается при ряде наследственных и приобретенных тромбоцитопатий. Точно так же нарушение синтеза простациклина в сосудистой стенке или снижение его поступления в кровь ведет к повышенной склонности тромбоцитов к агрегации, создает тромбогенную опасность [4].
ЭРИТРОЦИТЫ занимают почти половину всего объема крови, в норме отталкиваются друг от друга за счет выраженного статического заряда на мембране. В процессе свертывания крови эритроциты служат матрицей для сборки фибрина, теряют поверхностный заряд. Крупные агрегаты эритроцитов, склеенных фибрином «заиливают» кровь (сладж-феномен). Нитями фибрина эритроциты рвутся на осколки, при разрушении фрагментированные клетки выбрасывают тканевой тромбопластин – активатор внутреннего пути свертывания [2].
Высокая способность к деформации обеспечивает способность эритроцита проникать в сосуды, диаметром меньше, чем сама клетка. Эритроциты с высоким содержанием фибрина и фибриногена на мембране не способны проникать в капилляры, сбрасываются по шунтам между артериолами и венулами. Это приводит к нарушению микроциркуляции, оксигенации тканей [4].
МАКРОФАГИ – ключевые клетки, ориентирующие иммунный ответ на активацию свертывания крови, призванную локализовать возбудителя тромбами и препятствовать его распространению по организму. Синтезируют многие факторы свертывания крови, фактор некроза опухоли, а гибель макрофага сопровождается выбросом тканевого тромбопластина [2].
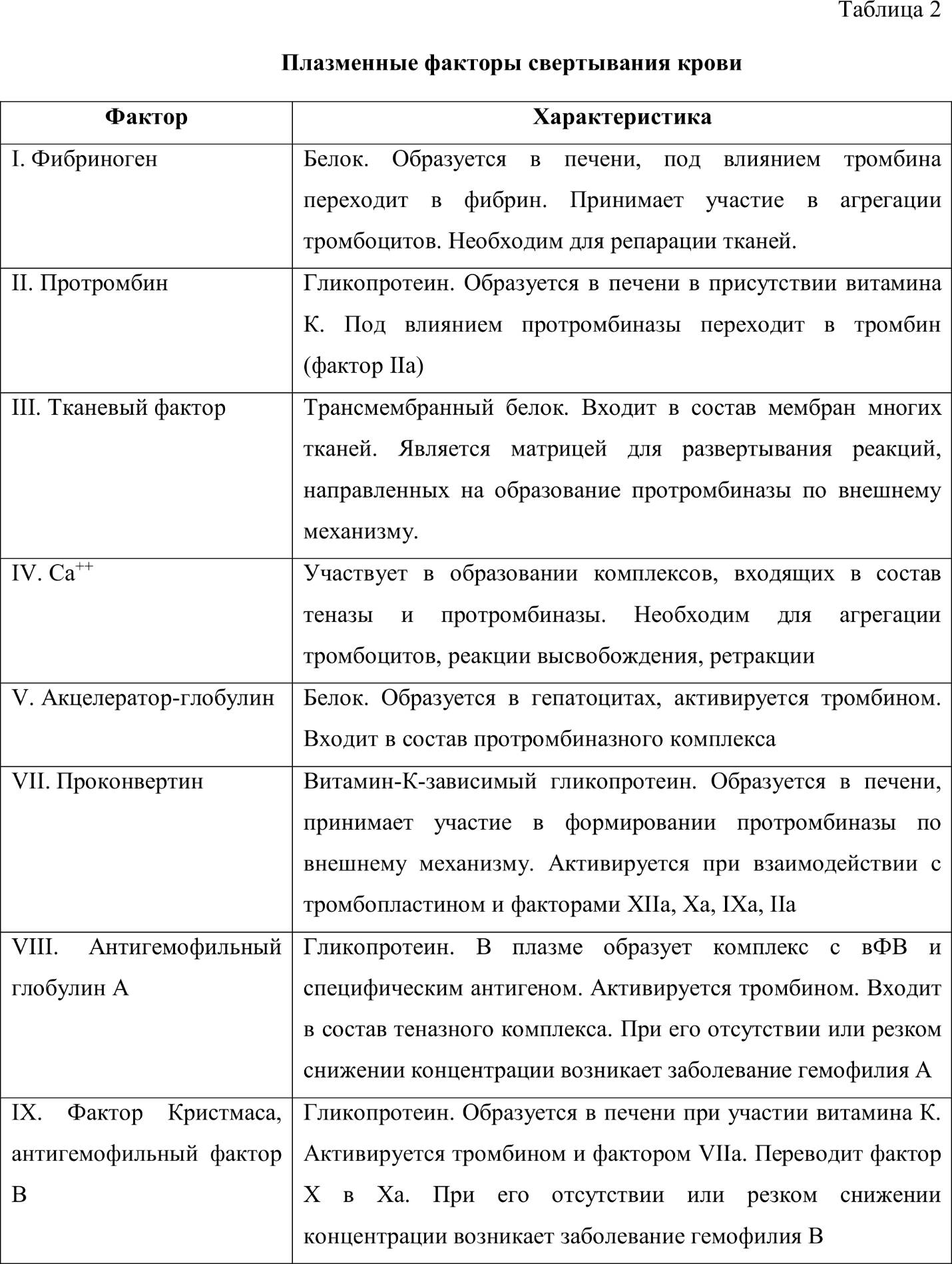
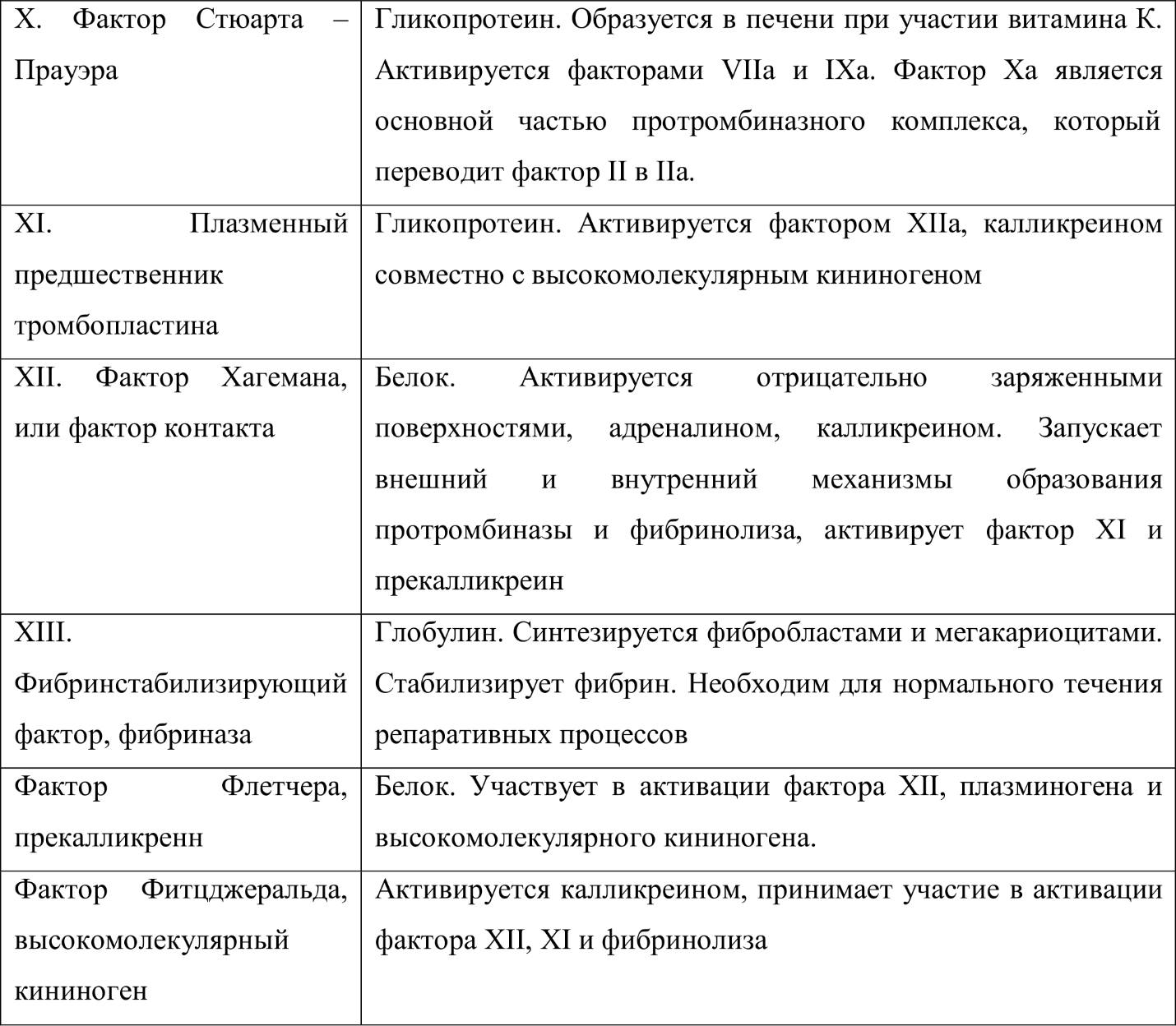
В. ПЛАЗМЕННЫЕ ФЕРМЕНТНЫЕ ФАКТОРЫ СВЕРТЫВАНИЯ
Большинство факторов свертывания крови представляют собой белки или гликопротеиды, которые синтезируются в клетках печени, и после выхода в кровяное русло, при условии интактности сосудистой стенки, циркулируют в нем в неактивном состоянии. Соприкосновение факторов свертывания с инородной поверхностью (поврежденными тканями сосудов) служит пусковым механизмом для их активации. Формируется проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, способны активировать другие факторы свертывания [1, 4, 5].
По решению международного комитета факторы свертывания обозначаются римскими цифрами в порядке хронологии их открытия (таблица 2).
1.2. Этапы (механизмы) гемостаза
Различают два основных механизма свертывания крови – сосудисто-тромбоцитарный и коагуляционный. Деление в хронологическом порядке носит условный характер, т.к. ряд процессов протекают одномоментно [1, 3, 6].
А. СОСУДИСТО-ТРОМБОЦИТАРНЫЙ МЕХАНИЗМ КОАГУЛЯЦИИ
Обеспечивается взаимодействием тромбоцитов и сосудистой стенки. В результате формируется непрочный тромбоцитарный тромб, обеспечивающий остановку кровотечения только из мелких сосудов [1, 6].
В ответ на повреждения сосудистой стенки под влиянием адреналина и норадреналина, а также высвобождающихся из тромбоцитов тромбоксана А2, серотонина и других биологически активных веществ возникает кратковременный первичный спазм сосуда. К месту повреждения сосуда, изменившему свой потенциал с отрицательного на положительный, устремляются тромбоциты, происходит их прикрепление к поврежденной поверхности – адгезия тромбоцитов. Фактор Фон Виллебранда, находящийся в эндотелии, плазме и тромбоцитах, активирует несколько своих центров. С помощью одного из них связывается с рецепторами тромбоцитов ГП Ib, с помощью другого – с субэндотелием или коллагеновыми волокнами поврежденного сосуда. Таким образом, с помощью данного фактора тромбоцит оказывается, как бы «подвешенным» к травмированной поверхности сосуда. В дальнейшем наступает агрегация тромбоцитов – их склеивание между собой у места сосудистого повреждения под воздействием усиленно выбрасывающегося в кровь из тромбоцитов АДФ и других хемоаттрактантов. Под влиянием АДФ многократно усиливается экспрессия ГП IIb/IIIa на мембране тромбоцитов, к которым крепятся нити фибриногена, связывающие близлежащих тромбоциты между собой. Клетки также «цепляются» друг за друга образовавшимися псевдоподиями. В результате образуется рыхлая тромбоцитарная пробка, через которую может проходить плазма крови. Это обратимая волна агрегации тромбоцитов [1].
На следующем этапе между тромбоцитами разрушается мембрана, они сливаются в однообразную массу, образуя конгломерат, непроницаемый для плазмы крови. Реакция происходит под влиянием тромбина, разрушающего мембрану тромбоцитов, что, в свою очередь, ведет к выходу из тромбоцитов физиологически активных веществ: серотонина, гистамина, нуклеотидов, ферментов и факторов свертывания крови. Их выделение способствует вторичному спазму сосудов. Фактор 3 тромбоцитов посредством тромбоцитарной протромбиназы запускает механизм плазменного гемостаза. С этого момента наступает необратимая волна агрегации тромбоцитов [6].
В дальнейшем под действием АДФ тромбоцитов из тубулярной системы происходит выход Са в цитоплазму, сокращение их актомиозиового комплекса и в конечном итоге – ретракция тромбоцитарного тромба – сокращение и уплотнение тромбоцитарной пробки, закрепление ее в поврежденном сосуде. В мелких сосудах гемостаз на этом заканчивается. Тромбоцитарный тромб, будучи непрочным, не выдерживает большого кровяного давления в крупных сосудах и вымывается. Включение коагуляционного механизма обеспечивает образование уже более прочного фибринового тромба [4, 5].
Б. ПЛАЗМЕННЫЙ МЕХАНИЗМ КОАГУЛЯЦИИ
Реализуется цепью последовательных реакций активирования комплекса белков, находящихся в плазме (плазменные факторы гемокоагуляции). На основе тромбоцитарного тромба формируется прочный фибриновый тромб, противодействующий кровопотере в сосудах диаметром более 100 мкм [2].
Плазменный механизм включает 3 основных этапа [1, 2, 4]:
1. Комплекс последовательных реакций, приводящих к образованию протромбиназы (комплекс Xa+Va), которая во вторую фазу обеспечит протеолитическое расщепление протромбина в тромбин.
2. Переход протромбина (фактор II) в тромбин (фактор IIа).
3. Превращение фибриногена (фактор I) в фибрин-мономер (фактор Im) и дальнейшая полимеризация фибрина с образованием в конечном итоге труднорастворимого фибрина-полимера.
Первый этап – образование протромбиназы (Xa+Va) – осуществляется по внешнему и внутреннему пути (механизму). И при внешнем, и при внутреннем пути активация факторов свертывания происходит на фосфолипидных мембранах поврежденных тканей и/или тромбоцитов.
Активация по внешнему пути протекает в течение нескольких секунд и опосредуется тканевым фактором (ТФ) – белком фосфолипидных мембан, выполняющего функцию трансмембранного рецептора. ТФ в изобилии находится в клетках, окружающих сосуды извне, что и определило название «внешний» путь активации. Внутренний механизм инициируется факторами, высвобождающимися из поврежденных клеток крови, преимущественно тромбоцитов и эритроцитов, а его продолжительность активации – минуты. Оба пути замыкаются на факторе Xа, и далее протекают одинаковым образом, и обозначаются как общий путь свертывания [1].
Разделение на внешний и внутренний пути активации свертывания крови является достаточно условным, поскольку в организме оба процесса тесно взаимосвязаны. Например, через активацию фактора IX активным фактором VII, а также посредством плазменного калликреина, который одновременно активирует факторы XII и VII. Однако подобное разделение упрощает интерпретацию лабораторных тестов, используемых для оценки состояния свертывания крови, в которых искусственно создаются условия для активации фактора X по внешнему или по внутреннему пути [6].
Второй этап – образование тромбина – играет одну из ключевых ролей в процессе формирования тромба. Образование тромбина в небольшом количестве в начальной фазе, когда сформировалась только тромбоцитарная пробка, с одной стороны, способствует разрушению тромбоцитов, выбросу в кровь биологически активных веществ и вторичному спазму сосудов, с другой – инициации 3-й фазы плазменного пути коагуляции, т.е. превращения фибриногена в фибрин [4]. Это так называемая фаза инициации свертывания. В дальнейшем происходит волнообразное значительное увеличение концентрации тромбина в зоне повреждения («тромбиновый взрыв»), который по механизму положительной обратной связи активирует сразу четыре механизма тромбообразования: 1) теназный комплекс (IXа+VIIIа) на мембране тромбоцитов (внутренний путь); 2) фактор XI, который в дальнейшем активирует фактор IX теназного комплекса; 3) фактор V, при взаимодействии которого с фактором X (внутренний и внешний пути) образуется протромбиназа; 4) массивное разрушение тромбоцитов с выделением серотонина, катехоламинов и др. веществ, способствующих коагуляции. Это фаза усиления свертывания.