
Энциклопедия клинической онкологии
Влияние канцерогенных веществ
Канцерогенные вещества – это вещества, которые достоверно вызывают образование опухоли или по крайней мере вызывают увеличение частоты заболеваемости раком. Большое количество канцерогенных веществ было выявлено во время экспериментов на животных, но из-за разницы в дозах, вызывающих эффект, и метаболических различий между видами нельзя полностью переносить результаты этих исследований на людей. Рассмотрим наиболее значимые в плане возникновения опухолей у людей канцерогенные вещества.
Достоверно выявить канцерогенный эффект той или иной группы веществ довольно сложно, что связано с отсутствием данных об этиологии большинства (95%) опухолей у человека, в большинстве случаев опухоли имеют многофакторное происхождение. Кроме того, большинство агентов, обладающих канцерогенными свойствами, являются причиной опухолей в относительно небольшом количестве случаев. Исключением являются факторы, связанные с курением.
Действие большей части химических канцерогенов связано с изменениями в ДНК, которые могут происходить в виде повреждения пуриновых и пиримидиновых оснований, деления хромосом, разрывов цепей и образования перекрестных связей. Часть химических канцерогенных веществ действует эпигенетически, т. е. они вызывают изменения в регулирующих рост белках без нарушений в геноме. Остальные могут действовать синергично с вирусами (дерепрессия онкогенов) или могут служить инициаторами для других канцерогенных веществ.
По механизму действия выделяют:
1) непосредственные или прямо действующие, канцерогенные вещества, т. е. те, которые действуют локально, в месте поступления в организм и не подвергаются метаболическим изменениям;
2) вещества, вызывающие опухоли только после метаболических преобразований в более активные формы внутри организма, называются проканцерогенами, а активные канцерогенные производные называются окончательными канцерогенными веществами.
Также канцерогены различаются по активности.
В экспериментальных условиях были определены минимальные концентрации некоторых веществ, обязательно вызывающие развитие опухоли. Например, для сахарина это 10 г/кг/д (огромная доза – канцерогенное вещество с низкой активностью), для 2-нафтиламина – 10-1 г/кг/д, бензидина – 10-2 г/кг/д и афлатоксина B1 – 10-6 г/кг/д (наиболее мощное известное канцерогенное вещество).
Рассмотрим наиболее значимые и изученные группы канцерогенов.
Полициклические углеводы: первым описанным канцерогенным веществом была сажа. П. Потт в 1775 в Лондоне установил, что сажа являлась причиной рака мошонки у трубочистов (так называемого профессионального рака). Сажа из дымоходов накапливалась в складках кожи мошонки, что приводило к развитию рака в ней. Позднее были определены активные канцерогенные вещества в саже и угольной смоле – это группа полициклических углеводов, наиболее активными из которых были бензапирен и дибензантрацен. В экспериментальных исследованиях на животных с применением малых количеств этих полициклических углеводов было доказано участие их в развитии рака кожи.
Курение сигарет: как было сказано выше, курение сигарет приводит к повышению риска возникновения рака. В особенности таких его форм, как рак легкого, мочевого пузыря, гортани и пищевода. Курение сигарет с фильтром и более новых сигарет с низким содержанием никотина и смол ненамного уменьшает риск. Имеются также доказательства того, что риск развития рака, связанного с курением, повышается не только у курильщика, но и у некурящих членов семьи и сотрудников. Рассчитано, что количество смертных случаев от рака из-за курения больше, чем от всех других известных канцерогенных веществ вместе взятых.
В сигаретном дыме содержится множество канцерогенных веществ, наиболее важными из которых являются полициклические углеводы (смолы). Хотя они являются прямо действующими канцерогенными веществами в коже, при развитии рака мочевого пузыря и легких они выступают как проканцерогены. Метаболизм их можно представить в следующем: вдыхаемые полициклические углеводы после преобразования в печени при помощи микросомального фермента арилгидроксилазы превращаются в эпоксиды. Эпоксиды (окончательные канцерогенные вещества) являются активными соединениями, связывающимися с аминокислотой гуанином в ДНК, что ведет к злокачественному преобразованию. При изучении рака легкого у курильщиков активность арилгидроксилазы была намного выше, чем у некурящих и курильщиков, не имеющих рака. Риск развития рака варьирует в различных исследованиях, но было установлено, что у человека, выкуривающего 1 пачку сигарет в день в течение 10 лет (10 лет «накопления»), он приблизительно в десять раз выше, чем у некурящего. Если курильщик бросает курить, то снижение риска возникновения рака до уровня некурящего происходит приблизительно через 10 лет.
Ароматические амины: воздействие ароматических аминов (бензидина, нафтиламина) вызывает увеличение частоты возникновения рака мочевого пузыря (впервые их действие было обнаружено у рабочих кожной и химической отраслей промышленности). Ароматические амины по механизму действия являются проканцерогенами, которые проникают в организм через кожу, легкие и кишечник, и их канцерогенный эффект проявляется в основном в мочевом пузыре. В организме они трансформируются в канцерогенные метаболиты, которые выделяются почками. Накопление мочи в мочевом пузыре усиливает канцерогенный эффект в слизистой оболочке. Различные биологические виды имеют неодинаковую чувствительность к действию ароматических аминов. Человек и собаки наиболее восприимчивы, крысы и кролики – намного меньше. Эти различия подтверждают то, что проканцерогены (которые должны преобразоваться в организме в окончательные канцерогенные вещества) могут оказывать различные влияния на разные виды из-за различий в метаболических процессах. Эти различия являются серьезным препятствием в изучении канцерогенности новых лекарств.
Цикламаты и сахарин: эти вещества являются искусственными подсластителями, которые широко используются больными с сахарным диабетом. Чаще всего большие количества этих веществ приводили к раку мочевого пузыря у экспериментальных животных. Четких доказательств канцерогенности их для человека нет, так как не определены их окончательные метаболиты.
Азокрасители: эти красители раньше использовались как продовольственные окрашивающие вещества, пока не было доказано, что они вызывают развитие опухолей печени у крыс. После этого были запрещены. Менее опасные представители этой группы, такие как трипановый синий и синька Эванса, до сих пор используются для окраски гистологических препаратов.
Нитрозамины: вещества взаимодействуют с нуклеиновыми кислотами и цитоплазматическими макромолекулами. Нитрозамины образуются путем преобразования нитритов в желудке. Нитриты находятся практически во всех продуктах, так как они часто используются как консерванты, главным образом в мясных продуктах – ветчине, колбасе и т. д. Прямое локальное действие нитрозаминов является наиболее важной причиной возникновения рака пищевода и желудка. Заметное снижение заболеваемости раком желудка в последние 2 десятилетия в США произошло благодаря улучшению условий хранения продовольствия с широким использованием холодильных установок, что позволило уменьшить потребность в консервантах. Высокая заболеваемость раком желудка в Японии связана с потреблением больших количеств копченой рыбы (содержащей полициклические углеводы), а не благодаря высокому содержанию нитрозаминов в продуктах.
Афлатоксин: это ядовитый метаболит, выделяемый грибом Aspergillus flavus, который, как предполагается, является основной причиной рака печени у людей. Гриб растет на неправильно хранимом продовольствии, особенно зерне и арахисе. В Африке поступление больших количеств афлатоксина с пищей сопровождается высокой частотой возникновения гепатоцеллюлярного рака. Метаболизм афлатоксина заключается в окислении печеночными ферментами, что приводит к появлению канцерогенного вещества, которое связывает гуанин в ДНК клеток печени. Попадание больших количеств токсина вызывает острый некроз клеток печени, сопровождаемый регенераторной гиперплазией и развитием рака. При поступлении меньших количеств (афлатоксин – очень мощное канцерогенное вещество) в течение длительного периода преобладает канцерогенный эффект.
Бетельный лист: жевание бетельного листа и бетельного ореха в Шри-Ланке и некоторых областях Индии связано с высокой заболеваемостью раком ротовой полости. Канцерогенный агент не был идентифицирован, но, как полагают, он присутствует или в бетельном орехе, или в измельченном известняке, или в табаке, которые обычно жуют вместе с бетельным листом.
Противоопухолевые лекарства: некоторые лекарства, используемые для лечения опухолей (алкилирующие агенты типа циклофосфамида, бисульфана, хлорамбуцила и тиотефа), воздействуют на синтез нуклеиновых кислот в опухолевых клетках, в нормальных клетках и могут вызывать злокачественные мутации. Наиболее частым неопластическим осложнением химиотерапии рака является такое заболевание крови, как лейкемия.
Асбест: асбест широко использовался как изоляционный и огнеупорный материал. Самое большое индивидуальное поражение асбестом происходило у рабочих верфей во время Второй мировой войны. Кроцидолит (разновидность асбеста), имеющий самые тонкие волокна (диаметр < 0,5 мм), представляет наибольшую опасность. Асбестоз также ведет к быстрой фиброзной пролиферации в плевре, что приводит к образованию волокнистых бляшек, которые вместе с фиброзом легочной ткани являются надежными радиологическими индикаторами запыления легких асбестом. Асбест способствует развитию двух типов злокачественных опухолей:
1) злокачественная мезотелиома – это редкое новообразование развивается из мезотелиальных клеток, главным образом в плевре, но также может наблюдаться в брюшине и перикарде. Почти все пациенты со злокачественной мезотелиомой имеют в анамнезе работу с асбестом;
2) бронхогенная карцинома – у людей, работавших с асбестом, риск возникновения рака легкого приблизительно в два раза выше, чем в популяции; риск значительно возрастает, если человек курит.
Промышленные канцерогенные вещества: было выявлено множество других агентов, вызывающих развитие опухолей, связанных с профессиональными вредностями. Рабочие в сельском хозяйстве больше подвержены заболеваемости раком кожи и в меньшей степени раком легких, что связано с мышьяком, который входит в состав некоторых пестицидов. У шахтеров повышение заболеваемости раком легкого связано с ингаляцией тяжелых металлов, таких как никель, хром и кадмий. Винилхлорид, используемый в производстве поливинилхлорида, связан с возникновением злокачественных сосудистых новообразований (ангиосарком) печени.
Гормональный онкогенез
Эстрогены — у больных с гормонально-активными (синтезирующими эстроген) опухолями яичника (зернисто-клеточная опухоль) или с постоянными нарушениями овуляции (возникающими в результате повышения уровня эстрогенов) часто развивается рак эндометрия. Эстрогены вызывают гиперплазию эндометрия, которая сопровождается сначала цитологической дисплазией, переходящей затем в неоплазию.
Гормоны и рак молочной железы – поскольку у мышей только женского пола развивался рак молочной железы после воздействия фактора молока Биттнера, было доказано, что эстрогены так или иначе причастны к возникновению заболевания. После введения мужским особям мышей эстрогенов они становились в одинаковой степени восприимчивыми к возникновению рака. Однако массовые обследования пациенток, принимающих оральные контрацептивы с высоким содержанием эстрогенов, показали, что риск развития рака молочной железы увеличивается незначительно. Современные контрацептивы с низким содержанием эстрогенов не увеличивают риска развития рака молочной железы.
Другим фактом гормонального онкогенеза было применение диэтилстилбэстрола (синтетический эстроген) в высоких дозах с 1950 по 1960 г. для лечения угрожающего выкидыша. У детей, которые внутриутробно были подвержены влиянию диэтилстилбэстрола, было определено значительное увеличение заболеваемости светлоклеточной аденокарциномой, которая является редким раком влагалища и развивается у молодых женщин между 15 и 30 годами.
Стероидные гормоны — использование оральных контрацептивов и анаболических стероидов иногда связывают с возникновением доброкачественных печеночноклеточных аденом. Также было описано несколько случаев возникновения печеночноклеточного рака.
2. Физический (лучевой) онкогенез
Многие виды излучений могут приводить к развитию опухолей, наиболее вероятно в результате прямого эффекта на ДНК или из-за активации клеточных онкогенов.
Ультрафиолетовое излучение
Солнечное ультрафиолетовое излучение играет роль в возникновении различных видов рака кожи, включая плоскоклеточный рак, базальноклеточный рак и злокачественную меланому. Новообразования кожи особенно часто возникают у светлокожих людей, находящихся длительно на солнце. Это объясняется недостаточным защитным эффектом кожного пигмента меланина. Напротив, рак кожи, включая меланому, очень редко наблюдается у темнокожих рас. Ультрафиолетовый свет, как полагают, стимулирует формирование связей между пиримидиновыми основаниями в молекуле ДНК. В норме измененная молекула ДНК быстро восстанавливается. Рак развивается при неэффективном функционировании механизмов репарации ДНК, что наблюдается у пожилых людей и у людей с пигментной ксеродермой.
Рентгеновское излучение
Первые рентгенологи, занимавшиеся изучением рентгеновского излучения, подвергались воздействию излучения с малой проникающей способностью. Часто у них развивался лучевой дерматит, что приводило к увеличению заболеваемости раком кожи. По мере увеличения проникающей способности излучения, у последующего поколения рентгенологов увеличилась заболеваемость лейкемией. Современные рентгенологи имеют высокоэффективные защитные средства против рентгеновского излучения. В 50-х гг. полагали, что увеличенный тимус является причиной обструкции дыхательных путей у грудных детей. Поэтому дети с респираторным дистресс-синдромом подвергались лучевой терапии шеи для уменьшения размеров тимуса, что привело к возникновению у большого количества этих детей папиллярного рака щитовидной железы через 15—25 лет. Одним из осложнений радиотерапии злокачественных опухолей является развитие индуцированных излучением злокачественных новообразований, обычно сарком, через 10—30 лет после лучевой терапии. Диагностические рентгенологические исследования используют настолько малые дозы радиации, что они не приводят к увеличению заболеваемости раком. Единственное исключение – это рентгенологическое исследование брюшной полости во время беременности, которое может привести к развитию лейкемии у плода.
Радиоизотопы
Канцерогенный эффект радиоактивных материалов впервые был определен в результате расследования причин возникновения большого количества остеосарком у рабочих фабрики, где использовались радийсодержащие краски в производстве люминесцентных циферблатов. Эти рабочие собирали волокна кисточек в тонкий пучок языком и губами, глотая, таким образом, большие количества радия. Радиоактивный радий попадает в кости, что и приводит к развитию остеосарком. Профессиональная вредность, обусловленная работой с радиоактивными полезными ископаемыми в шахтах Центральной Европы и Западной Америки, связана с увеличением заболеваемости раком легких.
Торотраст, радиоактивный препарат, содержащий радиоактивный торий, использовался в радиологической диагностике с 1930 по 1955 г. Торотраст накапливается в печени и увеличивает риск возникновения нескольких типов рака печени, включая ангиосаркому, печеночноклеточный рак и холангиокарциному (рак из желчных протоков).
Радиоактивный йод, который используется для лечения некоторых болезней щитовидной железы, приводит к увеличению риска развития рака, который возникает через 15—25 лет после лечения. Риск такой терапии оценивается по характеру первичной болезни, терапевтическому эффекту и возрасту пациента.
Радиоактивное загрязнение
Особенно крупной катастрофой, связанными с массивным радиоактивным загрязнением, является авария на Чернобыльской атомной электростанции в 1986 г., когда в атмосферу попали радиоактивный йод и ряд других радиоактивных изотопов, что привело к поражению десятков тысяч людей.
Памятна атомная бомбардировка Хиросиме и Нагасаки, после которой у людей значительно увеличилась заболеваемость лейкемией и раком молочной железы, легких и щитовидной железы. Жители Маршальских островов случайно подверглись воздействию радиоактивных осадков во время атмосферного испытания ядерной бомбы на юге Тихого океана. Радиоактивные осадки были богаты радиоактивным йодом, что привело к развитию множественных новообразований щитовидной железы.
Вся доза облучения, получаемая человеком при рентген– и радиоизотопных исследованиях, исходящая от атомных электростанций и т. п. в настоящее время составляет менее 1% от общего облучения; остальная доза приходится на излучения радиоактивных пород, непосредственно Земли и космических лучей (на неустранимое фоновое излучение).
3. Генетический онкогенез
В большинстве случаев генетическая предрасположенность к развитию новообразований возникает из-за унаследованной потери одного или нескольких генов подавления (супрессии) опухоли. Гены супрессии опухолей кодируют синтез веществ, регулирующих рост тканей. Потеря обеих генов, как правило, приводит к развитию опухолей. Потеря даже одного гена р53 приводит к нарушению и снижению функции клеток и неоплазии.
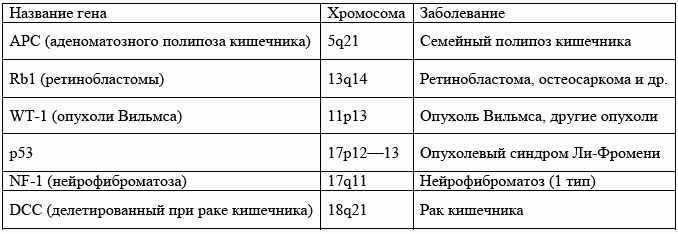
Таблица 1. Гены супрессии опухолей у человека
Новообразования с наследованием по законам Менделя
Ответственные за возникновение опухолей гены могут быть доминантными или рецессивными. Если ген является доминантным, то осуществляется синтез молекул, вызывающих образование опухоли. Если ген является рецессивным, то для развития опухоли необходимо отсутствие нормальных генов, необходимых для поддержания нормального контроля над ростом.
Ретинобластома – это редкое злокачественное новообразование сетчатки наблюдается у детей, и в 10% случаев оно является наследственным. Морфологические признаки семейной ретинобластомы не отличаются от ненаследственной формы. Однако семейная форма имеет характерные особенности: она обычно двусторонняя, при хромосомном анализе обязательно обнаруживается нарушение структуры длинного плеча 13 хромосомы (13q14, ген ретинобластомы Rb1), в некоторых случаях происходит спонтанное выздоровление. При этом личности с регрессировшей опухолью становятся носителями гена ретинобластомы и передают его потомству. Ретинобластома передается по доминантному типу в результате высокой частоты делеции первоначально нормальной 13 хромосомы. Таким образом, Rb1 ген является геном супрессии опухоли. При недавних исследованиях было обнаружено присутствие подобных нарушений в 13 хромосоме при некоторых других опухолях, включая остеосаркому и мелкоклеточный недифференцированный рак легкого. Кроме того, у выживших после семейной ретинобластомы, как оказалось, имеется высокий риск возникновения мелкоклеточного недифференцированного рака легких, особенно, если они курят сигареты.
Опухоль Вильмса (нефробластома) – злокачественное новообразование почки, которое развивается главным образом у детей. Во многих случаях определяется делеция части 11 хромосомы. Спорадические и семейные случаи имеют механизм сходный с таковым при ретинобластоме. Также нарушения в 11 хромосоме (11p13) идентифицируются при других типах опухолей. WT-1 также является геном супрессии опухоли.
Другие унаследованные новообразования также имеют наследственную предрасположенность. Ранее полагали, что они наследуются по доминантному типу, но это представление было переоценено после открытия рецессивных генов супрессии опухолей.
1. Нейрофиброматоз (1 тип болезни Реклингаузена) – эта опухоль характеризуется развитием множественных нейрофибром и пигментированных пятен неправильной формы на коже (цвета «кофе с молоком»). При нейрофиброматозе, NF-1 ген (хромосома 17q11) или отсутствует, или имеет нарушенное строение, что ведет к потере NF-1 супрессорного белка. NF-1 белок, как предполагается, регулирует активность производных (гуанин-связывающие «G» белки) протоонкогена. При потере NF-1 рост-активирующий эффект G белков ничем не компенсируется.
2. Множественный эндокринный аденоматоз – проявлением данного заболевания являются доброкачественные новообразования в щитовидной, паращитовидных железах, гипофизе и мозговом веществе надпочечников.
3. Семейный полипоз кишечника – полипоз кишечника характеризуется многочисленными аденоматозными полипами в кишечнике. Имеется потеря гетерозиготности на длинном плече 5 хромосомы, APC гена. В конечном итоге развивается рак кишечника у всех пациентов, которым не выполняется колонэктомия. Данное заболевание является самым наглядным доказательством теории многочисленных толчков, последовательно приводящих к возникновению злокачественного новообразования. Синдром Гарднера – вариант, при котором кишечные полипы сочетаются с доброкачественными новообразованиями и кистами в костях, мягких тканях и коже.
4. Синдром невоидного базальноклеточного рака – это нарушение характеризуется диспластическими меланоцитарными невусами и базальноклеточным раком кожи.
Новообразования с полигенетическим наследованием
Многие распространенные новообразования являются семейными в меньшей степени, т. е. они возникают у родственных личностей более часто, чем в популяции вообще.
Рак молочной железы – родственники (матери, сестры, дочери) женщин, заболевших раком молочной железы в предменопаузном периоде, имеют повышенный риск возникновения рака молочной железы (в пять раз выше, чем в общей популяции).
Рак кишечника – рак кишечника обычно наблюдается в семьях с наследственным семейным полипозом кишечника.
4. Вирусный онкогенез
ДНК– и РНК-вирусы могут стать причиной неоплазий. Существуют различные методики для выявления присутствия вирусного генома в клетке:
1) определение вирус-специфичных антигенов на инфицированных клетках;
2) методом гибридизации обнаруживаются вирус-специфичные последовательности нуклеиновых кислот;
3) обнаружение вирус-специфичной мРНК.
Онкогенные РНК-вирусы
Онкогенные РНК-вирусы (ретровирусы, которые раньше назывались онкорнавирусами) являются причиной многих новообразований у экспериментальных животных. Роль ретровирусов была доказана и для некоторых опухолей человека.
1. Японская T-клеточная лейкемия. Эта форма лейкемии была впервые описана в Японии. Ретровирус (человеческий T-лимфоцитарный вирус I типа [HTLV-I]) был выделен из клеток этой опухоли. Предполагают, что вирус играет прямую этиологическую роль.
2. Опухоли, связанные с ВИЧ-инфекцией. Вирус иммунодефицита человека (ВИЧ) является ретровирусом (лентивирусом), который поражает в основном Т-лимфоциты (хелперы) человека и вызывает развитие синдрома приобретенного иммунодефицита (СПИДа). Доказана роль этого вируса в онкогенезе злокачественных B-клеточных лимфом при СПИДе.
3. Другие опухоли – имеются неточные доказательства вирусного происхождения некоторых опухолей кроветворной системы. Биоптаты тканей, взятых от многих пациентов с лейкемиями и лимфомами, содержат вирусную обратную транскриптазу, а также имеются сообщения о выделении вируса в культурах или идентификации вирусной нуклеиновой кислоты в ДНК опухолевых клеток при лейкемии.
Онкогенные ДНК-вирусы
Несколько групп ДНК-вирусов могут быть причиной новообразований у человека.
Вирусы папилломы — эти вирусы вызывают доброкачественные эпителиальные новообразования в коже и слизистых оболочках, включая обычные бородавки, остроконечные кондиломы и рецидивирующие папилломы гортани (палилломатоз гортани).
Вирус Эпштейна—Барра (EBV) – этот герпес-вирус является причиной инфекционного мононуклеоза – широко распространенного острого инфекционного заболевания. Также он причастен к развитию лимфомы Беркита и назофарингеального рака.
Вирус гепатита В – этот вирус, как полагается, является причиной печеночноклеточого рака в Африке, где наблюдается высокая заболеваемость гепатитом В и имеется большое количество носителей данного вируса. Длительная пролиферация печеночных клеток (регенерация) в ответ на вирусное повреждение, вероятно, является основным фактором, предрасполагающим к неопластической трансформации.

