
Гнойно-септическая инфекция в акушерстве и гинекологии
В целом материнская смертность от гнойно-воспалительных заболеваний имеет тенденцию к снижению: в последние 10 лет она составила 4 на 100 000 родов по сравнению с 6 – 7 случаями на 100 000 в предыдущие 15 лет.
Снижение материнской смертности от сепсиса, перитонита тем более очевидно, что оно происходит на фоне значительного роста частоты операции кесарева сечения, т. е. фактически в 2 раза больше, чем в предыдущие 5 лет и в 3 – 5 раз больше, чем в 1971 – 1985 гг. В то же время, именно операция кесарево сечение является основной причиной тяжелой раневой инфекции послеродового периода – перитонита, эндометрита, сепсиса.
М. А. Репина (1997) полагает, что снижение летальности от сепсиса, перитонита объясняется соответствующей организацией службы родовспоможения, при которой обеспечен своевременный вывоз заболевших в городской специализированный центр.
Имеет значение и общее снижение частоты тяжелых инфекционно-воспалительных осложнений в родильных домах, что связано с уменьшением числа родов в городе и, следовательно, лучшими условиями для выполнения санитарно-противоэпидемического режима в родильных домах с созданием палат совместного пребывания матери и ребенка.
Отказ от кормления детей по часам, переход к совместному пребыванию матери и ребенка в родильных домах привел к резкому (более чем в 2 раза) снижению частоты лактационных маститов. Кроме того, в 1991 – 1995 гг. в специализированное отделение поступило только 73 больных сепсисом, перитонитом, что фактически в 2 раза меньше, чем в 1981 – 1985 гг. (соответственно 38,4 и 71,4 на 10 тыс.) [Репина М. А., 1997].
В Европе удалось резко уменьшить материнскую смертность, например в Великобритании в 100 раз. Едва ли ни третье место среди причин материнской смертности занимают ятрогенные осложнения (по разным данным, от 15 до 24,6 %). В том числе так называемая «наркозная смерть» составляет по РФ около 5 % [Серов В. Н., Маркин С. А., 2003]. Среди причин материнской смертности, обусловленной анестезией, особенно смерти в результате общей анестезии, в США, например, ведущей причиной является аспирация. Смешанные причины включают в себя аллергические реакции, неадекватное разрушение миорелаксантов, внутривенную перегрузку, эпизод послеоперационной асфиксии и неправильное проведение эпидуральной блокады у пациенток с заболеваниями сердца.
• Неудавшаяся интубация трахеи. Анализ материнской смертности в результате анестезии выявил, что проблемы «трудной интубации» относятся к наиболее часто встречаемой категории ее причин.
Смертность в результате регионарной анестезии. Коллапс сердечно-сосудистой системы.
Токсичность местных анестетиков.
Не распознанные события во время региональной блокады. Таким образом, снижение материнской смертности, обусловленной анестезией, требует внимательного назначения сильнодействующих препаратов квалифицированным персоналом. Поскольку в многопрофильных больницах анестезиологическая служба объединена, круглосуточная анестезия в акушерстве, обеспечиваемая даже общими анестезиологами в составе хорошо оснащенных, полностью укомплектованных родильных бригад должна повысить безопасность матерей и новорожденных [Серов В. Н., Маркин С. А., 2003].
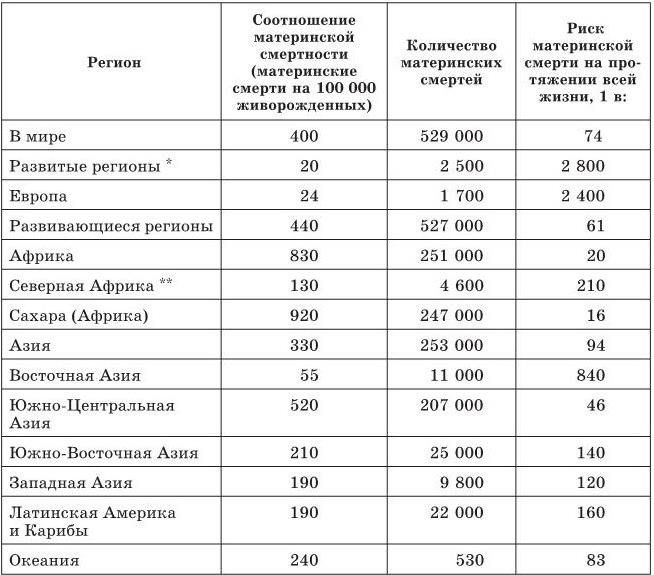
По данным ВОЗ, ЮНИСЕФ, ЮНФПА (2004), приведены данные о материнской смертности в 2000 г., уменьшение материнской смертности явилось одной из главных целей нескольких современных интернациональных конгрессов. При этом количество материнских смертей в 2000 г. в мире составило 529 000.
Количество смертей было почти равным при распределении между Африкой (251 000) и Азией (253 000) и приблизительно около 4 % (22 000) в Латинской Америке и на Карибских островах, и менее чем 1 % (2500) в большинстве развитых регионов мира. При определении соотношения материнской смертности (ММР) в мире составило 400 на 100 000 живорожденных. Наивысшим это соотношение было в Африке (830), затем Азии (330), Океании (240), Латинской Америке и Карибских островах (190) и в развитых странах (20).
Наивысшая материнская смертность отмечена в Индии (136 000), затем Нигерии (37 000), Пакистане (26 000), Демократической республике Конго и Эфиопии (24 000), Объединенной республике Танзания (21 000), Афганистане (20 000), Бангладеше (16 000), Анголе, Китае и Кении (11 000 в каждой стране), Индонезии и Уганде (по 10 000 в каждой). Эти 13 стран составили 67 % всех материнских смертей (табл. 1).
При этом риску материнской смерти при беременности на Сахаре подвергается 1 женщина из 16 в течение ее жизни по сравнению с 1 женщиной из 2 800 в развитых странах. Однако определение частоты материнской смертности в различных регионах мира представляется трудной проблемой по многим причинам, в частности демографическим, экономическим, социальным, системой здоровья (антенатальная помощь и др.).
Таблица 1
Материнская смертность в мире за 2000 г.
(ВОЗ, ЮНИСЕФ, ЮНФПА) [WHO, UNICEF, UNFPA, 2004]
*Включая в дополнение к Европе, Канаду, США, Японию, Австралию и Новую Зеландию, которые были исключены из общих регионов.
**Исключая Судан, который был включен в регион Сахары (Африка).
Глава 2
ЭТИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ВАЖНЕЙШИХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Анатомические и физиологические изменения во время беременности объясняют многие особенности протекания местных и общих инфекционных процессов у женщин. Многие инфекционные заболевания у беременных женщин протекают тяжелее, чем у небеременных. Из-за токсического действия возбудителя или из-за передачи его плоду может произойти выкидыш.
Местные воспалительные процессы в репродуктивных органах отражаются на способности к зачатию, вынашиванию плода. Нормальные роды нередко сопровождаются послеродовыми гнойно-септическими осложнениями. Заболевания органов репродуктивной системы настолько часты у женщин 15 – 45 лет, если они живут половой жизнью, что те или иные заболевания встречаются у большинства с локализацией процесса в верхних или нижних отделах полового тракта. Последствия воспалительных заболеваний женских половых органов включают возможность внематочной беременности, бесплодия, не говоря уже о постоянных или рецидивирующих болях внизу живота и в пояснице.
Ранняя диагностика и раннее начало лечения любых воспалительных заболеваний женских гениталий снижают инфекционную заболеваемость и предупреждают возникновение тяжелых последствий в виде бесплодия, заражения новорожденных детей.
Пробелы в терапии этих заболеваний связаны с поздним установлением этиологического анамнеза, поздним назначением лечения и выбором неадекватного лечебного препарата, что приводит к воздействию не только на возбудителя заболевания, но и на естественную микрофлору половых путей, которая служит первым защитным барьером на пути внедрения патогенных микроорганизмов. Поэтому полезно знать количественные и качественные параметры нормальной микрофлоры гениталий.
НОРМАЛЬНЫЙ БИОЦЕНОЗ ЖЕНСКИХ ГЕНИТАЛИЙ
Микробиозом принято называть совокупность микроорганизмов, населяющих влагалище и часть шейки матки. Н о рмальный микробиоценоз – это состав микрофлоры влагалища. Его основу составляют облигатные анаэробные бактерии, изучение которых началось относительно недавно, факультативные бактерии, не требующие для своего развития строго анаэробных условий, а также аэробы и микроаэрофилы, нуждающиеся в кислороде. Влажность, температура, наличие питательных веществ, оптимальная концентрация ионов водорода и значений окислительно-восстановительного потенциала поддерживают рост и размножение микроорганизмов.
Микрофлора влагалища постоянно обогащается за счет попадания микроорганизмов из прилегающих областей – кожи промежности, наружных гениталий, уретры, околоанальной области, однако она всегда более обильна, нежели микрофлора смежных областей. У здоровых женщин в период от менархе до менопаузы во влагалище доминируют молочнокислые бактерии нескольких видов. Они способны расщеплять глюкозу с образованием органических кислот, главной из которых является молочная кислота. Водородный показатель (pH) влагалищной среды составляет 4,0 – 4,5, что препятствует размножению большинства микроорганизмов, для которых благоприятна нейтральная или слабощелочная среда.
Характер микробиоты влагалища тесно связан с гормональной функцией яичников. В препубертатном периоде и после наступления менопаузы во влагалище вегетирует микрофлора, свойственная коже наружных гениталий.
У женщин репродуктивного возраста во влагалище доминирует лактобациллярная микрофлора. Несмотря на это, множество других микробных видов – бактерий, дрожжеподобных грибов, микоплазм – присутствуют в этой открытой полости. Среди них часто встречаются грамположительные кокки (эпидермальный и золотистый стафилококки, энтерококки, стрептококки разных серологических групп), коринебактерии, грамотрицательные бактерии кишечной группы, а также многочисленные виды анаэробных бактерий. В среднем из одной пробы влагалищного содержимого выделяют от 4 до 10 разных видов микроорганизмов.
В механизме заселения уретры, влагалища, шейки матки играют роль две категории факторов: те, которые обеспечивают микроорганизмам возможность выжить в этих областях, и те, которые позволяют бактериям прикрепиться к поверхности эпителиальных клеток. Специфическое прикрепление (адгезия) обеспечивается специальными приспособлениями бактериальной клетки – выростами в виде пилей и фимбрий, особыми химическими соединениями лектинами – гликопротеинами, которые обладают способностью ковалентно присоединяться к рецепторам клетки эпителия. Существует и межбактериальная адгезия, или опосредованная адгезия, при которой клетки организма-хозяина служат местом прикрепления одних видов бактерий, а на них прикрепляются другие виды. Число рецепторов на одной клетке ограничено. Закрепившись на рецепторах, микроорганизмы продуцируют полисахариды, обволакивающие микробную клетку. В результате образуется гликокаликс, который защищает бактерии от неблагоприятных для них влияний – антител, лизоцима, бактериофагов, простейших. В состоянии биопленки микроорганизмы в десятки и сотни раз более устойчивы по сравнению с нахождением их в свободно плавающем состоянии.
Регулирующее влияние на количество и состав микрофлоры оказывают антимикробные вещества неспецифического действия, образуемые клетками организма-хозяина, – лизоцим, трансферрин, комплемент, интерфероны, а также специфически действующие антитела, содержащиеся в цервикальной слизи.
И все же наиболее заметное влияние на индигенную микрофлору половых путей оказывает гормональное состоян и е. Повышенная секреция эстрогенов сопровождается утолщением слизистой оболочки, ороговением и слущиванием поверхностного слоя эпителия влагалища, который служит субстратом для обильного размножения лактобацилл. Степень зрелости влагалищного эпителия и количественное содержание лактобацилл тесно связаны между собой. При менструациях микрофлора половых путей меняется количественно и качественно. За 7 дней до менструаций содержание факультативных бактерий снижается в 100 раз, одновременно резко возрастает количество анаэробов. Такое состояние продолжается во время менструального кровотечения и неделю спустя после него.
Среди экзогенных влияний на микрофлору половых путей необходимо отметить внесение бактерий во влагалище при спринцеваниях, при половом акте. Лекарственные препараты общего и местного действия могут подавлять естественную микрофлору, и в условиях конкуренции за субстрат и пространство может быть нарушен баланс между отдельными микробными видами, как это имеет место при бактериальном вагинозе. Ассоциация гарднерелл, анаэробных видов бактерий, генитальных микоплазм вытесняет лактобациллы вначале частично, затем полностью. Продукты метаболизма анаэробных бактерий обусловливают неприятный аминный запах выделений из влагалища, напоминающий запах рыбы.
Большинство микробных заболеваний женских половых органов является болезнями, передаваемыми половым путем. Таковы не только сифилис, гонорея, трихомоноз, генитальный герпес, генитальный хламидиоз, мягкий шанкр, но и ряд так называемых новых венерических болезней, о передаче которых половым путем ранее не было известно. К их возбудителям относятся вирус гепатита B, вирус цитомегалии человека, вирус иммунодефицита человека, вирусы папилломы человека, менингококки, шигеллы. Возможна смешанная инфекция, вызванная несколькими сексуально трансмиссибельными агентами, а также участие в инфекционном процессе бактерий из состава нормальной микрофлоры, вторично инвазирующей поврежденные ткани.
КОЛОНИЗАЦИОННАЯ РЕЗИСТЕНТНОСТЬ И УЧАСТИЕ УСЛОВНО-ПАТОГЕННОЙ МИКРОФЛОРЫ В ВОЗНИКНОВЕНИИ ИНФЕКЦИЙ ГЕНИТАЛИЙ
Термин колонизационная резистентность был введен в научную литературу относительно недавно (1981) и означает совокупность механизмов, придающих стабильность микрофлоре и предотвращающих заселение данной ниши посторонними микроорганизмами.
Наличие индигенной, главным образом анаэробной, микрофлоры является одним из основных механизмов защиты половых путей от патогенных бактерий. Выраженный антагонический эффект в отношении широкого круга патогенов проявляют лактобациллы, которые помимо образования молочной кислоты продуцируют перекись водорода и бактериоцины, угнетающие развитие посторонних микроорганизмов. Кроме того, лактобациллы и неспорообразующие анаэробы проявляют высокую конкурентоспособность в заселении экологической ниши. Индигенные бактерии формируют достаточно плотную биопленку, а хорошо выраженный гликокаликс препятствует адгезии посторонних бактерий на рецепторы клеток эпителия.
Снижение колонизационной резистентности приводит к дисбалансу резидентной микрофлоры влагалища. При нормальной эстрогенной насыщенности создаются благоприятные условия для размножения лактобацилл и неблагоприятные для грамотрицательных аэробных и факультативно анаэробных бактерий кишечной группы. Многие исследователи указывают на то, что в III триместре беременности во влагалищном биоценозе нередко отмечается присутствие дрожжеподобных грибов, при этом даже в большом количестве. Следует признать, что это физиологическое изменение микробиоценоза нередко ошибочно трактуется как влагалищный микоз, который следует медикаментозно регулировать, что вряд ли целесообразно.
Введение в практику контрацептивных средств, как оральных, так и внутриматочных, снова привлекло внимание врачей к составу влагалищной микрофлоры. Уже в 1960-е гг. появились сообщения о том, что применение оральных (гормональных) контрацептивов сопровождается учащением кандидозного вульвовагинита и возникновением воспалительного процесса. Однако специальные исследования состава микробиоты влагалища у женщин, пользующихся длительное время оральными контрацептивами, показали, что грибы рода кандида одинаково часто обнаружены как у пользующихся оральными контрацептивными препаратами, такиунепользующихся ими, хотя видовой состав кандид не одинаков. Потенциально более патогенный вид Candida albicans чаще встречался у женщин, пользующихся оральными контрацептивами, в то время как у тех, кто ими не пользовался, выделены потенциально менее патогенные виды — Candida guillermondi, Candida krusei, Torulopsis glabrata.
Внутриматочные контрацептивы могут заселяться микроорганизмами, проникающими в полость матки из влагалища. Среди микробных видов, которые находили на удаленном контрацептивном средстве, доминировали актиномицеты и негемолитические стрептококки, микроорганизмы с низкой потенциальной патогенностью, которые редко вызывают воспалительные заболевания. При осложнениях в виде тубоовариальных абсцессов в удаленных во время операции массах находили, кроме актиномицет, неспорообразующие анаэробы.
Современные гигиенические средства – вагинальные тампоны и прокладки привлекли к себе внимание в первую очередь потому, что они не стерилизуются перед выпуском в продажу. Тампоны тесно прилегают к стенкам влагалища, на них могут находить условия для своего развития разнообразные обитатели влагалища, изменяя состав микрофлоры. Использование вагинальных тампонов во время менструаций, за счет увеличения питательных веществ для бактерий, впитываемых из крови, казалось бы, должно решительно менять микробный состав и количество бактерий во влагалище. Обширные исследования показали, однако, что существенных изменений во влагалищной микробиоте не происходит. При этом тампоны из разных материалов (хлопок, вискоза, смесовый материал) и прокладки из этих же материалов не увеличивают содержания грамотрицательных факультативных бактерий, как этого можно было ожидать.
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ВЛАГАЛИЩА
Воспалительные заболевания влагалища часто сопровождаются более или менее выраженными воспалительными симптомами заболевания вульвы. В таких случаях принято говорить о вульвовагинитах.
Таблица 2
Типы вульвовагинитов у взрослых
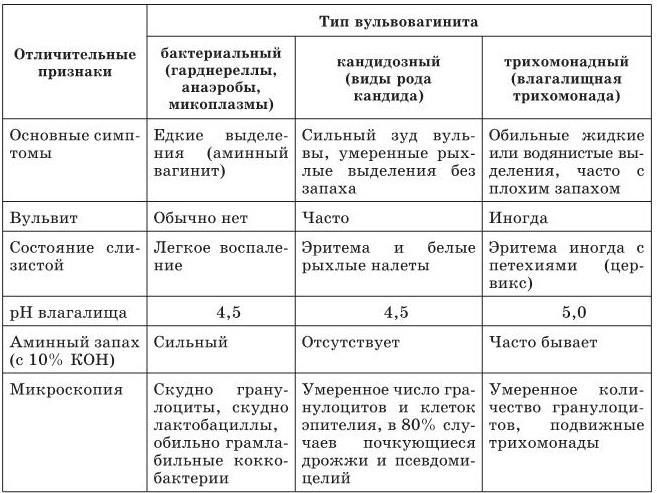
Среди воспалительных заболеваний влагалища следует остановиться на трех основных типах, в диагностике которых обращает на себя внимание стремление практикующих врачей применять сложные современные методы выявления возбудителя заболевания, в то время как вполне достаточны в подавляющем большинстве случаев простые общедоступные приемы. В табл. 2 приведены отличительные признаки различных типов вульвовагинитов.
БАКТЕРИАЛЬНЫЙ ВАГИНОЗ
Из трех типов воспалительных заболеваний влагалища самым частым является бактериальный вагиноз, он встречается у 30 – 40 % женщин. Как видно из табл. 2, воспалительные проявления минимальны, жалобы больных на обильные выделения с неприятным запахом. Микрофлора влагалища при этом заболевании характеризуется резким уменьшением лактобацилл и наличием огромного количества смешанной микрофлоры: грамлабильных коккобактерий, вибрионов (род Mobiluncus), грамотрицательных нежных тонких палочек (род Bacteriodes). Дискуссия о значении при этой патологии Gardnerella vaginalis как единственного агента – возбудителя заболевания завершилась признанием этиологической роли ассоциации микроорганизмов, состоящей из Gardnerella vaginalis, Bacteroides spp., Mobiluncus spp. и др. Сейчас принято считать, что бактериальный вагиноз – это дисбактериоз влагалища, однако патогенез этого состояния остается неясным. Применение антибиотиков, активных в отношении анаэробов, дает лечебный эффект, но рецидивы заболевания часты. Достаточных подтверждений сексуального пути передачи заболевания не получено.
Лабораторная диагностика. Основу диагностики составляют следующие признаки:
– слабо выраженное воспаление стенки влагалища;
– отсутствие или незначительное количество лейкоцитов в мазке;
– жидкие обильные выделения с запахом рыбы;
– выделение аммиака при добавлении к капле выделений раствора КОН;
– отсутствие или незначительное количество лактобацилл в мазке;
– обильная смешанная микрофлора, покрывающая клетки эпителия влагалища с образованием так называемых ключевых клеток (clue cells).
Для лабораторного подтверждения диагноза нет необходимости проводить посевы влагалищных выделений. Достаточно произвести микроскопию нативного или окрашенного препарата из влагалищных выделений. Совокупность перечисленных выше признаков и характерная картина в микроскопическом препарате не оставляют сомнений в диагнозе.
КАНДИДОЗНЫЙ ВУЛЬВОВАГИНИТ
Кандидозное поражение слизистой влагалища является вторым по распространенности заболеванием женщин репродуктивного возраста. Существует также кандидозное поражение органов мочевой системы. У мужчин кандиды вызывают воспалительный процесс головки полового члена, крайней плоти и мочевых органов.
Дрожжеподобные грибы широко распространены в природе. Заболевания у людей возникают при гормональном дисбалансе, дефектах общего и местного иммунитета, нарушениях нормального микробиоценоза полостей вследствие передозировки антибиотиков широкого спектра действия, при этом в качестве возбудителя заболевания выступают грибы, находящиеся в организме, — эндогенная инфекция. Передача кандид при половом контакте не имеет достаточного подтверждения.
Клинически кандидозный вагинит проявляется ясно различимыми признаками, хотя существуют атипичные формы заболевания, особенно при рецидивирующем течении.
Дрожжеподобные грибы Candida относятся к семейству Criptococcaceae несовершенных грибов Deuteromycetes,поскольку не имеют половых форм размножения и половых спор. Морфологически они являются одноклеточными организмами, клетки имеют круглую или овальную форму, а также образуют нитевидные формы при линейном расположении почкующихся элементов – гифы и псевдогифы. Как и все эукариоты, грибы рода Candida имеют оформленное ядро, иногда несколько ядер. Клетка окружена клеточной стенкой, содержащей хитин и целлюлозу. Величина дрожжевой клетки 3 – 4 мкм. Кроме псевдогифов кандиды могут образовывать истинные гифы, которые имеют параллельные стенки и септы, в то время как псевдогифы на концах суживаются.
При исследовании вагинальных выделений наиболее часто встречается вид C. albicans (около 90 %), а также и другие виды этого рода — C. tropicalis, C. krusei, C. parapsilosis, C. guillermondi. Встречаются грибы рода Torulopsis – T. glabrata.Внастоящее время T. glabrata признаны нормальной составной частью влагалищной микрофлоры.
Кандиды хорошо растут на простых питательных средах, в том числе на кровяном агаре, сусло-агаре, картофельном и рисовом агаре, среде Сабуро с глюкозой или мальтозой. Колонии кандид влажные, кремового цвета, выпуклые, блестящие или матовые. Виды кандид различают по ассимиляции углеводов как единственного источника питания и по ферментации углеводов.
Лабораторная диагностика. Микроскопический метод является предпочтительным, поскольку у 20 % здоровых женщин во влагалище в небольших количествах присутствуют кандиды, которые вырастут при посеве, что даст основание для неправильного диагноза кандидоза влагалища.
Культуральный метод полезен при хроническом рецидивирующем течении заболевания, при атипичных формах, когда исключены другие возможные возбудители.
В лабораторию врач присылает препарат-мазок из отделяемого влагалища и пробирку с ватным тупфером, которым был взят материал из заднего свода влагалища или уретры, а также среднюю порцию свободно выпущенной мочи в стерильной пробирке. Для микроскопии используют неокрашенные препараты, а также обработанные раствором КОН, окрашенные метиленовой синью, по Граму, по Романовскому – Гимзе.
В основе диагноза лежит обнаружение элементов гриба: единичных почкующихся клеток, псевдомицелия, других морфологических структур (бластоконидии, псевдогифы). Решение о значимости обнаруженных дрожжеподобных грибов принимает клиницист.
Культуральный метод. Полученный от больной материал после микроскопии засевают на 2 – 3 среды (сусло-агар, кровяной агар, плотная среда Сабуро, среда Vagicult фирмы «Orion Diagnostica» (Финляндия). Инкубация происходит при 37 C, так как патогенные для человека грибы вырастают при этой температуре, в то время как для сапрофитов этот режим неблагоприятен.
Оценивают полуколичественно рост на плотных средах и отвивают чистые культуры для последующей идентификации. На рисовый агар делают разреженный посев (разведения или посев штрихом для получения изолированных колоний). Поверх посева накладывают покровное стекло, оставляют культуру на 18 – 48 ч при комнатной температуре, после чего микроскопируют в фазово-контрастном микроскопе или при опущенном конденсоре. Оценивают форму псевдогифов, расположение псевдоконидий вдоль псевдогифов.
Для быстрого определения C. albicans делают посев в капилляре на среду с лошадиной или телячьей эмбриональной сывороткой. Этот вид кандид (самый частый) через 2 ч инкубации дает росток псевдогифа.
При необходимости дальнейшей точной идентификации используют наборы углеводов для проверки их утилизации и ферментации. Очень удобны наборы фирмы «Abbott», которые благодаря компьютерной программе производят определение вида дрожжеподобного гриба. В настоящее время аналогичные наборы как для компьютерного, так и визуального учета ферментации углеводов имеются на отечественном рынке.
УРОГЕНИТАЛЬНЫЙ ТРИХОМОНОЗ