
Мастопатия и гинекомастия
В коже соска находятся пучки гладких мышечных волокон, которые идут в круговом и радиальном направлении и распространяются на область поля соска. Внутренняя мускулатура соска имеет вид взаимно перекрещивающихся тяжей. По оси соска располагается ряд гладкомышечных и соединительнотканных волокон, составляющих как бы опору для радиальных мышц.
Способность соска к эрекции прежде связывали с его многочисленными кровеносными сосудами, построенными как бы аналогично пещеристому телу клитора. Оказалось, однако, что эти сосуды ничем не отличаются от обычных периферических сосудов. Было высказано предположение, что эрекция соска зависит от сокращений его мышечных волокон, возбуждаемых сосательными движениями ребенка. Впоследствии это предположение было полностью подтверждено.
Есть основание утверждать, что эрекция соска является рефлекторным актом центрального происхождения, идущим от коры головного мозга и направляемым и регулируемым нейрогуморальной системой. В пользу этого говорят не вызывающие сомнений факты возникновения у здоровых молодых женщин эрекции соска психогенным путем, например при половом возбуждении. На это также указывает повышение эректильности соска и его чувствительности в фазе овуляции.
Молочная железа подвержена циклическим изменениям, особенно резко выраженным при беременности. Подобные же изменения наблюдаются у взрослых здоровых женщин и вне беременности, во время менструального периода.
В предменструальный период наблюдается отечность и разрыхление внутридольковой ткани; она широкопетлиста, содержит умеренное количество клеточных элементов. Число железистых ходов увеличено; просвет их широк, местами обнаруживаются слущившиеся клетки, миоэпителиальный слой (набухший, вакуолизированный).
Во время менструации происходит клеточная инфильтрация внутридольковой ткани, причиной которой является обильное скопление лимфоцитов, плазматических клеток. Особенно сильная инфильтрация вокруг более крупных ходов. В просвете железистых ходов содержатся жировые капли, слущившийся эпителий, а в более крупных ходах – множество эритроцитов.
В постменструальный период разрыхление внутридольковой соединительной ткани исчезает, поэтому железистые поля очень резко отграничены от окружающей ткани. Клеточная инфильтрация в железистых полях еще сохраняется, но исчезает вокруг крупных ходов; железистые просветы в дольке резко сужены; оболочка альвеол (membrana propria) широка, гомогенна.
В середине менструального периода идет процесс уплотнения. Некоторые волоконца внутридольковой соединительной ткани приобретают вид плотных коллагеновых волокон и мало отличаются от волокон стромы. Некоторые волокна стромы как бы входят внутрь железистых полей, потому резкое отграничение последних, наблюдающееся в предыдущем периоде, исчезает.
Кровоснабжение молочных желез осуществляется в основном внутренней грудной (a. mammaria interna) и боковой грудной (a. thoracalis lateralis) артериями (рис. 4). Первая из них, в которой наиболее развита третья ее наружная ветвь (a. mammaria externa), подходя с медиальной стороны, снабжает кровью дольки железы (паренхиму), околососковое поле, сосок и кожу железы (медиальную ее сторону). Вторая питает своими ветвями (rami mammarii externi) эти же образования, но с латеральной стороны. Задняя поверхность железы снабжается кровью от проникающих в нее тонких ветвей межреберных артерий (rami aa. intercostales). Перечисленные артерии образуют две анатомические сети (поверхностную и глубокую), от этих сетей отходят тонкие ветви, направляющиеся к соску.
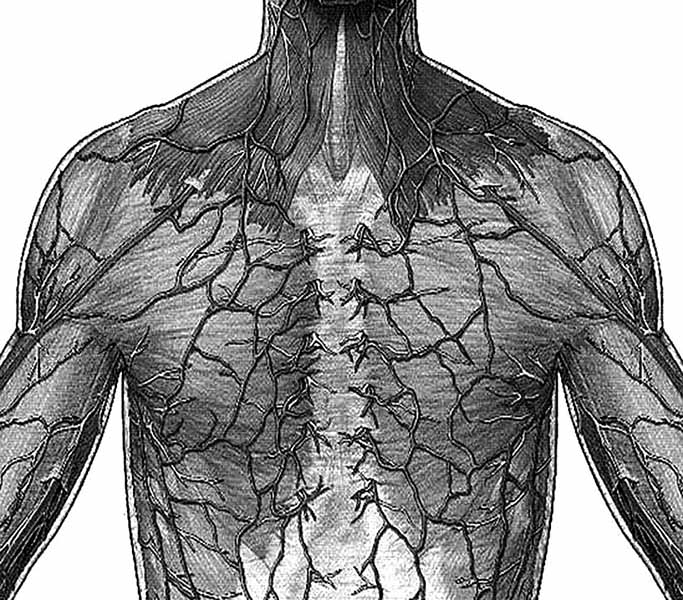
Рис. 4. Кровоснабжение молочных желез (артериальное: 60 % – внутренняя грудная артерия; 30 % – наружная грудная артерия; 10 % – ветви межреберных артерий; венозный отток во внутренние и наружные грудные и межреберные вены)
Глубокие вены сопровождают артерии, поверхностные – образуют подкожную сеть, связанную с подмышечной веной.
Лимфоотток осуществляется несколькими сетями лимфатических сосудов (рис. 5). В области соска и его поля лимфатические сосуды образуют густую сеть, широко анастомозирующую с лимфатическими сосудами противоположной молочной железы и с такой же сетью, расположенной более глубоко, между дольками железы.
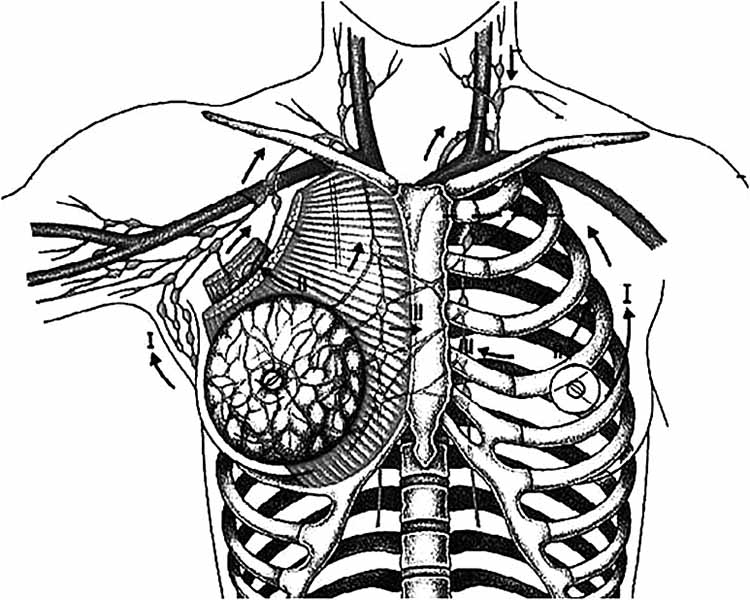
Рис. 5. Лимфоотток молочных желез (от наружных квадрантов – в подмышечные лимфоузлы, от внутренних – в парастернальные лимфоузлы, от верхних – в надключичные)
Кроме того, имеется несколько путей, отводящих лимфу от молочных желез и играющих большую роль в распространении патологических процессов (гнойного, бластоматозного). Главный путь лимфы идет от латеральной части железы к подмышечным лимфатическим узлам. Добавочные пути анастомозируют друг с другом и с лимфатическими путями плевры, поддиафрагмального пространства и печени. При этом (Д. Н. Лубоцкий и др.) одна часть лимфатических сосудов направляется через толщу большой грудной мышцы к глубоким подмышечным лимфатическим узлам, лежащим под малой грудной мышцей; другая часть сосудов (между большой и малой грудной мышцей) направляется к подключичным узлам, часть сосудов попадает в надключичную область, минуя подключичную область, чем объясняются поражения раком глубоких шейных узлов при отсутствии метастазов в подключичных. Лимфатические сосуды, отходящие от железы с медиальной стороны, впадают в грудинные узлы вдоль внутренней грудной артерии (a. мammaria interna), а также в подмышечные узлы противоположной стороны. Имеются также лимфатические сосуды, направляющиеся в надчревную область и анастомозирующие с сосудами плевры, поддиафрагмального пространства и печени.
В целях стандартизации методики и объема удаляемых лимфатических узлов подмышечную ямку принято разделять на 3 уровня:
– первый уровень – лимфатические узлы, расположенные кнаружи от малой грудной мышцы по ходу подключичной вены, подлопаточные, подмышечные (в том числе центрально расположенные);
– второй уровень – лимфатические узлы в подмышечной ямке, располагающиеся под малой грудной мышцей;
– третий уровень – труднодоступные подключичные лимфатические узлы, расположенные медиальнее малой грудной мышцы.
Иннервация молочных желез происходит от шейного сплетения через надключичные нервы (nn. supraclaviculares) и из плечевого сплетения через передние грудные нервы (nn. thoracales anteriores), а также от 4–6-го межреберных нервов (nn. intercostales). Волокна симпатических нервов достигают железы по кровеносным сосудам. Нервы молочной железы относятся как к мякотным, так и к безмякотным. Последние построены по типу ремаковских ядросодержащих нервных волокон и в основном иннервируют молочные протоки. Мякотные же волокна иннервируют сосуды. Оба вида волокон вокруг долек железы образуют крупнопетлистую нервную сеть, от которой отдельные ветви идут к сосудам, молочным протокам и гладкомышечным волокнам. Часть этих ветвей образует междолевое нервное сплетение, а отходящие от него нервные волокна формируют межальвеолярное сплетение, веточки которого проникают через оболочки альвеол, образуя здесь густую сеть. При этом они достигают наружной поверхности железистого эпителия, обусловливая его секрецию. Внутрь клеток концевые нервные аппараты не проникают.
В соске имеются разнообразные инкапсулированные и неинкапсулированные нервные окончания: тельца Годжи-Маццони, тельца Фатер-Пачини, генитальные тельца. По-видимому, инкапсулированные окончания являются рецепторами давления. Давление передается из окружающей ткани на поверхность капсулы и далее, через инкапсулированную жидкость, на внутреннюю колбу и заключенное в ней нервное волокно, возбуждая последнее. В соске передача давления происходит через ряд капсул, расположенных по длине нервного волокна, чем обусловливается высокая чувствительность рецептора соска во время сосания. Существует предположение, что свободные древовидные нервные окончания, лежащие глубоко в паренхиме железы, являясь монорецепторами, сигнализируют о состоянии и степени наполнения самих железистых клеток. Бескапсулярные клубочки, содержащие большое количество различных клеток и располагающиеся в междольковой соединительной ткани, являются хеморецепторами – они сигнализируют об изменениях химизма тканей.
М. М. Миронов и Л. Н. Воскресенский (из лаборатории И. П. Павлова) установили наличие связи нервов молочной железы со спинным и головным мозгом. Связь эта носит рефлекторный характер.
1.4. Факторы риска
Мастопатия – многопричинное заболевание, связанное как с генетическими факторами, так и с влиянием окружающей среды и образом жизни пациенток.
В настоящее время выявлены условия, способствующие возникновению и развитию заболеваний молочных желез. Это позволяет выделить контингент женщин с повышенным риском заболевания.
Причин возникновения ДЗМЖ огромное количество. По данным Л. Н. Сидоренко (1991), основными из них являются:
1. Фрустирующие (стрессовые) ситуации, которые присутствуют в жизни каждой женщины (неудовлетворенность семейным положением, а также положением в обществе, бытовые конфликты, конфликтные ситуации на работе, психические стрессы и др.). Любой стресс сопровождается различными функциональными нарушениями нейроэндокринной системы.
2. Факторы сексуального характера.
3. Факторы репродуктивного характера (количество беременностей, родов, абортов, возраст при беременности и родах, рождение крупного плода, длительность лактации, время появления менархе и наступления менопаузы и др.).
4. Гинекологические заболевания и в первую очередь воспалительные процессы в малом тазу.
5. Эндокринные нарушения (дисфункция щитовидной железы, метаболический синдром, синдром поликистозных яичников, сахарный диабет 1-го и 2-го типов и др.).
6. Патологические процессы в печени и желчных путях.
7. Наследственная (генетическая) предрасположенность.
Факторы, влияющие на появление коварной болезни, вызванной несбалансированностью гормональных компонентов, разнообразны.
Их условно можно разделить на две группы: факторы внешнего и внутреннего воздействия.
К первой группе относятся все без исключения экологические проблемы.
К повышению риска развития ЗМЖ ведут неблагоприятные факторы окружающей среды, в первую очередь ионизирующая радиация (пример – значительный рост заболеваемости раком молочной железы в тех регионах Японии, которые подверглись атомной бомбардировке в конце Второй мировой войны). Имеются достоверные статистические данные, что ЗМЖ встречаются в 2–2,5 раза чаще у жительниц городов, нежели у женщин, проживающих в сельской местности.
Вторую группу составляют факторы, непосредственно влияющие на гормональный баланс.
Предменструальная масталгия в рамках предменструального синдрома увеличивает риск развития изменений в клетках ткани МЖ в 2–2,5 раза.
Неблагоприятными факторами являются слишком раннее менархе и поздняя менопауза, ановуляторные циклы, поздняя первая беременность, отказ от кормления ребенка грудью, искусственные прерывания беременности.
Неблагоприятные изменения в тканях МЖ находятся в прямой зависимости от времени появления менархе и первой беременности и в обратной – от количества детей. Своевременное менархе и первая беременность в 18–20 лет оказывают защитное влияние – у первородящих до 19 лет риск появления патологических процессов в МЖ более чем в 3 раза ниже, чем у женщин, впервые родивших в 35 лет и позже. С увеличением количества нормальных родов уменьшается риск возникновения указанных изменений.
Наследственность: наличие рака молочной железы у кровных родственников 1-й степени родства по материнской линии увеличивает риск развития онкологических изменений в МЖ в 4–5 раз.
Крайние показатели антропометрических данных (масса тела, рост) могут быть отнесены к факторам риска развития заболеваний МЖ, так как они, как правило, имеют прямую причинно-следственную связь с нейроэндокринными нарушениями.
Повышается риск возникновения мастопатий и рака молочных желез под влиянием таких неблагоприятных факторов, как отсутствие беременности или поздняя первая беременность, отсутствие грудного вскармливания или его короткий период.
Почти все исследователи акцентируют внимание на возрасте, в котором произошли первые и последующие роды. В частности, у женщин, родивших двоих детей до 25 лет, втрое меньший риск развития заболеваний молочных желез по сравнению с имеющими только одного ребенка. Возраст также является важным фактором риска развития рака. Обычно частота возникновения рака молочных желез прогрессивно повышается с возрастом и составляет 30–50 % к 75 годам.
Обнаружена связь повышенного риска заболевания раком с ранним наступлением менструаций и поздним их прекращением.
Следовательно, к факторам, оказывающим защитный эффект, относятся: ранние роды (20–25 лет), кормление грудью, количество родов (более двух) с полноценной лактацией.
Кормление ребенка грудью менее 1-го месяца, лактационный период более 1 года повышают риск развития заболеваний МЖ.
Многие ученые подчеркивают, что особенно неблагоприятно на состоянии МЖ сказывается количество абортов (три и более), поскольку желтое тело в полной мере «расцветает» во время беременности. После прерывания беременности оно продолжает длительное время функционировать, что сопровождается поступлением в кровь избыточного количества прогестерона. Это приводит к подавлению выработки лютеинизирующего гормона (ЛГ) гипофиза и повышению продукции фолликулостимулирующего гормона (ФСГ). В результате возникает дисбаланс гормонов, что приводит к преобладанию процессов пролиферации в тканях органов-мишеней.
Искусственное прерывание беременности значительно повышает риск развития патологии молочных желез. У женщин, которым проведено 3 медицинских аборта и более, риск развития мастопатии увеличивается в 7,2 раза. Аборт прерывает пролиферативные процессы в молочных железах, и ткань подвергается обратному развитию. Эти регрессивные изменения происходят неравномерно и зачастую могут приобрести патологический характер.
Среди этиологических факторов дисгормональных гиперплазий МЖ значительная роль принадлежит гинекологическим заболеваниям, в первую очередь воспалительным процессам придатков матки, которые благодаря механизму обратной связи могут быть причиной значительных структурных и функциональных нарушений гипофизарно-яичниковой оси. Это связано с тем, что МЖ, как и матка, являются органом-мишенью для половых гормонов. По данным М. С. Габуния (1999) и А. Б. Ильина (2004), довольно высокая частота (60–92 %) доброкачественных заболеваний МЖ отмечается у женщин с эндометриозом и миомой матки. Причем чаще всего гинекологическая патология сочетается с диффузными изменениями в МЖ. При генитальном эндометриозе и миоме матки диффузная мастопатия отмечалась в 72 % и 66 % случаев соответственно, а узловая форма мастопатии констатирована в 17 % и 18 % случаев наблюдений. Следует отметить, что при миоме матки чаще выявляются кисты МЖ и узловая мастопатия (18 %). Л. М. Бурдина (1998) указывает, что у женщин, страдающих гиперпластическими гинекологическими заболеваниями (эндометриоз, миома матки, гиперплазия, эндометрия, полипы), в 74,4 % случаев развивается диффузная и узловая формы мастопатии, сопровождающиеся гиперплазией железистого компонента. Следует отметить, что при генитальном эндометриозе в МЖ преобладает (37 %) гиперплазия железистого компонента, в то время как при миоме матки чаще (36,4 %) наблюдается гиперплазия железистого и фиброзного компонентов стромы (Н. А. Огнерубов, 2001).
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Вы ознакомились с фрагментом книги.
Для бесплатного чтения открыта только часть текста.
Приобретайте полный текст книги у нашего партнера:
Всего 10 форматов