 0
0Рабочая тетрадь-тренажер по биохимии для студентов специальности «Лечебное дело»
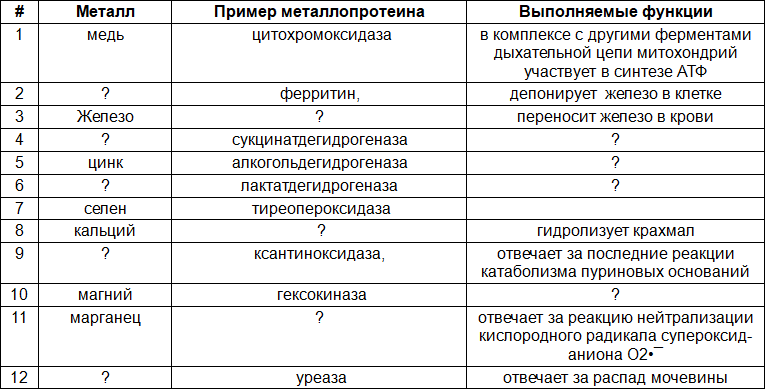
На рисунке представлена схема строения сложного белка – гемоглобина взрослого человека (HbA).
Покажите, как выглядит график зависимости насыщения кислородом этого белка.
Подпишите оси X (степень насыщения белка кислородом, %), Y (Парциальное давление газа, мм рт. ст).
В той же системе координат покажите зависимость насыщения кислородом двух сложных белков – миоглобина (Mb), фетального гемоглобина (HbF). Какова способность всех трех белков к насыщению кислородом?
ЗАДАНИЕ 3На рисунке представлены графики зависимости насыщения гемоглобина кислородом в разных условиях.
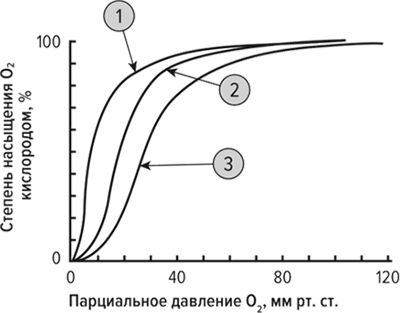
На графике укажите кривую, соответствующую кривой насыщения гемоглобина кислородом при уменьшении концентрации CO2. Объясните ответ.

Объясните эффект Бора в связывания гемоглобина с кислородом.

На графике укажите кривую, соответствующую кривой насыщения гемоглобина кислородом в отсутствии 2,3-бисфосфоглицерата. Объясните ответ.

Опишите биологическую роль 2,3-бисфосфоглицерата в регуляции связывания гемоглобина с кислородом.

ЗАДАНИЕ 4
Сила, с которой кислород связывается с гемоглобином, зависит сразу от нескольких факторов. Эти факторы сдвигают или изменяют форму кривой диссоциации оксигемоглобина. Сдвиг вправо указывает на то, что исследуемый гемоглобин имеет пониженное сродство к кислороду. Это затрудняет связывание гемоглобина с кислородом (для достижения того же насыщения кислородом требуется более высокое парциальное давление кислорода), но облегчает выделение гемоглобином связанного с ним кислорода.
Заполните недостающие параметры в таблице, описывающей графики зависимости насыщения гемоглобина кислородом в разных условиях.
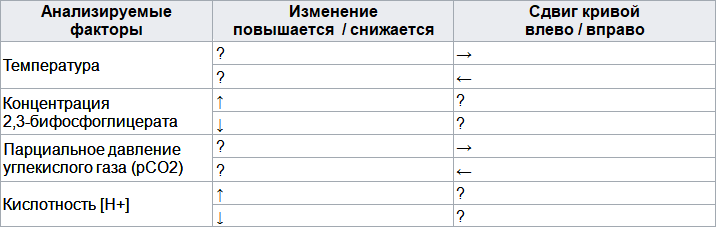
Пояснение:

ЗАДАНИЕ 5
Серповидноклеточная анемия (рисунок картины крови ниже) – наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение. Форма гемоглобина больных – так называемый гемоглобин S.
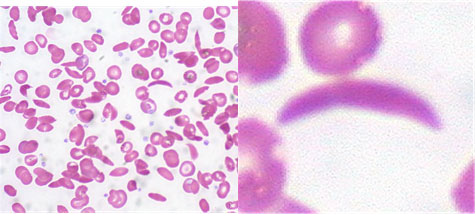
Каковы биологические и физико-химические свойства гемоглобина в норме и что меняется при патологии? Дайте объяснение на основе схемы ниже:

Пояснение:

ЗАДАНИЕ 6
Талассемия (рисунок картины крови ниже) – генетическое заболевание, возникает при повреждении генов гемоглобина и тяжесть заболевания зависит от глубины поломки генов. При талассемии наблюдаются характерные изменения в клиническом анализе крови. Резко снижены количество эритроцитов, уровень гемоглобина (при тяжелых формах – иногда до 20–30 г/л) и цветовой показатель. Эритроциты крови уменьшенного размера, зачастую необычного вида – так называемые «мишеневидные».
Какова структура глобиновых цепей гемоглобина в норме? Опишите их.
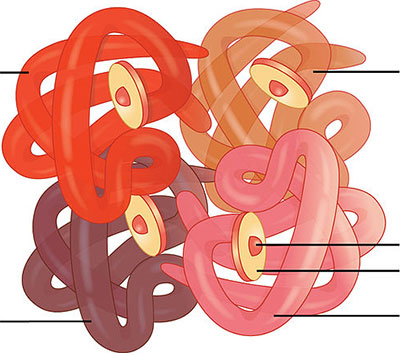
На рисунке подпишите составные части гемоглобина:
В таблице представлены характеристики трёх белков.
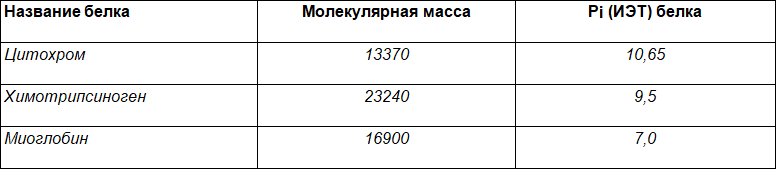
В чем вы видите отличия между ними? Предложите методы, которые можно использовать для разделения этих белков. Дайте обоснование своему выбору.
Опишите особенности структуры и биологические функции каждого из представленных белков.
Решение:

ЗАДАНИЕ 8
Подпишите составные части гема. Найдите структуры пиррола, метиленовые мостики и остатки пропионовой кислоты.
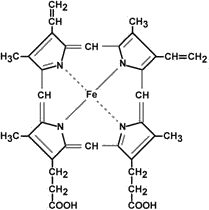
Что является полярной частью молекулы?
Какова роль железа в этой структуре?
Назовите гемовые белки в организме человека.
ЗАДАНИЕ 9Известно, что к металлопорфиринам относятся ферменты, принадлежащие к семейству цитохромов Р-450 (рис. ниже). Эти ферменты и существует в различных биообъектах (в растениях, бактериях и млекопитающих). Ферменты Р-450 играют ключевую роль в окислительной трансформации эндогенных и экзогенных молекул, а их активный центр содержит протопорфирин железа(III)-IX, ковалентно связанный с белком атомом серы проксимального цистеинового лиганда.
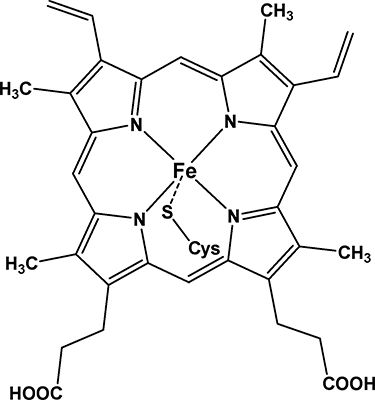
Предположите, с какими структурными особенностями Р-450 связана их способность участия в ОВР.
ЗАДАНИЕ 10*Объясните, остатки каких аминокислот в структуре белковой молекулы, могут давать гликоконьюгаты?
Составьте формулы продуктов взаимодействия между соответствующими аминокислотами и остатками моносахаров (глюкозы и галактозы)
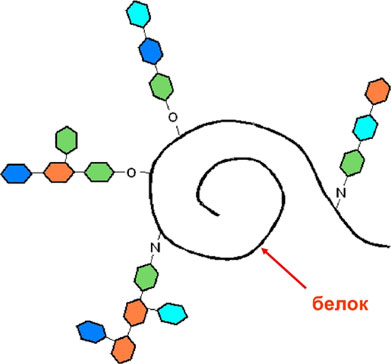
Решение:

ЗАДАНИЕ 11
По смыслу предложения, продумайте, какие слова необходимо включить в текст:
1. Эпителиальные клетки животных продуцируют гликопротеины муцины. Эти гликопротеины являются основными компонентами _____________________________________
_____________________________________
оболочек тканей. Муцины обеспечивают таким оболочкам_____________________________________
_____________________________________
, _____________________________________
_____________________________________
, выполняют защитные функции тканей, например, предохраняют от протеолитического действия _____________________________________
_____________________________________
и кишечного сока, участвуют в процессах минерализации, способны связывать патогены. Молекулярная масса муциновых комплексов достигает 20 Мда.
Компоненты выбора:
• слизистых
• влажность
• эластичность
• прочность
• желудочного
• ликвора
2. Присоединение углеводных цепей к полипептидам осуществляется посредством_____________________________________
_____________________________________
связи. К настоящему времени выявлено несколько способов соединения моносахаридов с аминокислотами. Наиболее распространены два типа присоединия: _____________________________________
_____________________________________
связь и _____________________________________
_____________________________________
связь. Реже встречается соединение посредством S-гликозидной связи по остаткам _____________________________________
_____________________________________
и С- гликозидной связи между остатками D- маннозы и триптофана
• сложноэфирной
• гликозидной
• N – гликозидная
• О- гликозидная
• треонина
• цистеина
ЗАДАНИЕ 12*Используя схему образования гликозидной связи между N-ацетилглюкозамином и остатками аминокислот, составьте свои схемы возможных гликозидов между парами:
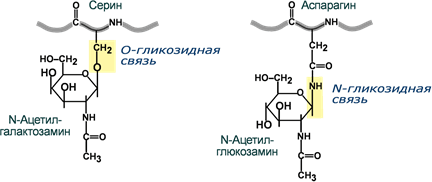
Серин – глюкоза
Аспарагин – галактоза
Треонин – галактоза
Глутамин – глюкоза
Решение:

ЗАДАНИЕ 13
Используя схему образования сложноэфирной связей связи между фосфорной кислотой и остатками аминокислот, составьте свои схемы возможных гликозидов между парами:
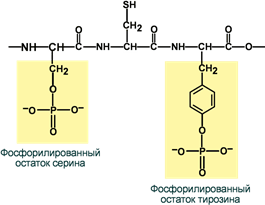
Тирозин – фосфорная кислота
Треонин – фосфорная кислота
Решение:

Тема 5, Ферменты

Основы биокатализа. Особенности ферментов как биокатализаторов: зависимость скорости реакции от физических и физико-химических условий среды (температура, ионная сила, рН); высокая избирательность (субстратная специфичность и специфичность действия). Активный центр, его адсорбционный и каталитический участки. Понятия о коферментах и кофакторах. Теория индуцированного соответствия. Отличия ферментов от неорганических катализаторов. Классификация и номенклатура ферментов. Активность ферментов, единицы ее измерения. Молекулярная и удельная активность фермента. Кинетика ферментативного катализа. Энергетический профиль химической реакции. Энергия активации, переходное состояние. Уравнение Михаэлиса-Ментен. Регуляция ферментативной активности. Уравнение Лайнуивера-Берка, его графическое представление. Ингибирование по механизму обратной связи. Обратимое ингибирование фермента как механизм действия лекарственных препаратов. Изоферменты, их роль в клинической лабораторной диагностике. Понятие о рибозимах и абзимах.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Вы ознакомились с фрагментом книги.
Для бесплатного чтения открыта только часть текста.
Приобретайте полный текст книги у нашего партнера:
Полная версия книгиВсего 10 форматов

