
Химия для студентов-медиков: общая, физическая и коллоидная химия. Практикум-рабочая тетрадь

Татьяна Лобаева, Дмитрий Жданов
Химия для студентов-медиков: общая, физическая и коллоидная химия. Практикум-рабочая тетрадь
Утверждено Методическим советом Медицинского университета МГИМО-МЕД
Рецензенты:
Чистяков М. В. – кандидат физико-математических наук, доцент кафедры нормальной физиологии и медицинской физики, «Научно-образовательный институт «Высшая школа клинической медицины им. Н. А. Семашко», ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России
Нестерова О. В. – доктор фармацевтических наук, заведующая кафедрой химии образовательного департамента Института фармации им. А. П. Нелюбина Сеченовского университета, заслуженный работник здравоохранения.
Предисловие к изданию
Целью освоения дисциплины «Общая, физическая и коллоидная химия» является формирование необходимых как для обучения последующим учебным дисциплинам, так и для непосредственного формирования медика, системных знаний о физико-химической сущности и механизмах процессов, происходящих в организме человека; изучение закономерностей химического поведения основных биологически важных классов неорганических и органических соединений, необходимых для рассмотрения процессов, протекающих в живом организме на молекулярном, надмолекулярном и клеточном уровнях.
Пособие «Химия для студентов-медиков: общая, физическая и коллоидная химия. Практикум-рабочая тетрадь» составлено авторами на основе многолетнего педагогического опыта в ведущих медицинских ВУЗах РФ в соответствии с ФГОС и рассчитано для использования в учебном процессе по направлению подготовки 31.05.01 Лечебное дело (специалитет), а также для студентов других медицинских специальностей: 33.05.01. Фармация (специалитет), 31.05.03 Стоматология (специалитет).
Сборник включает краткое теоретические введение, методики лабораторных работ и разноплановый комплект учебно-методических материалов по 3 основным разделам курса химии для студентов-медиков:
• Введение в химию. Основные понятия и законы химии.
• Общая химия. Физическая химия
• Коллоидная химия
Темы заданий и задач данного пособия соответствуют одному семестру изучения общей, физической и коллоидной химии для студентов специальности «Лечебное дело» и других медицинских специальностей.
Пособие адресовано студентам-медикам, аспирантам, стажерам и преподавателям для текущего использования в учебном процессе, а также для аттестации студентов.
КОЛЛЕКТИВ АВТОРОВЛобаева Татьяна Александровна – кандидат биологических наук (специальность «Фармацевтическая химия, фармакогнозия»), доцент по специальности «Биохимия», преподаватель кафедры фундаментальных дисциплин Медицинского университета МГИМО-МЕД.
Автор свыше 80 учебно-методических и научных работ по фармацевтической и токсикологической химии, молекулярной биологии, биохимии, педагогике.
Жданов Дмитрий Дмитриевич – доктор биологических наук, заведующий лабораторией медицинской биотехнологии ИБМХ им. В. Н. Ореховича, доцент по специальности «биохимия», профессор кафедры биохимии им. акад. Берёзова Т. Т. МИ РУДН.
Автор свыше 100 научных и учебно-методических работ по молекулярной биологии, биохимии, медицине.
Раздел 1. Введение в химию. Основные понятия и законы химии
1.1. Введение в химию. Основные понятия и законы химии. Классификация химических соединений. Строение атома. Химическая связь
Часть 1. Теоретическое введение
Химический элемент – вид атомов с одинаковым зарядом ядра.
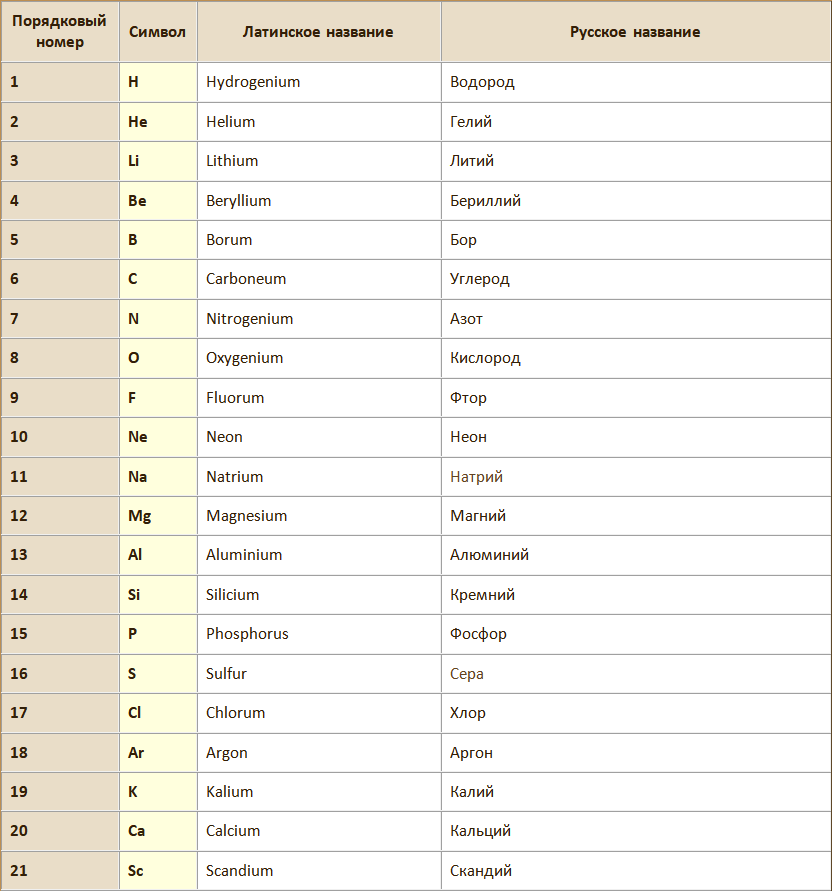
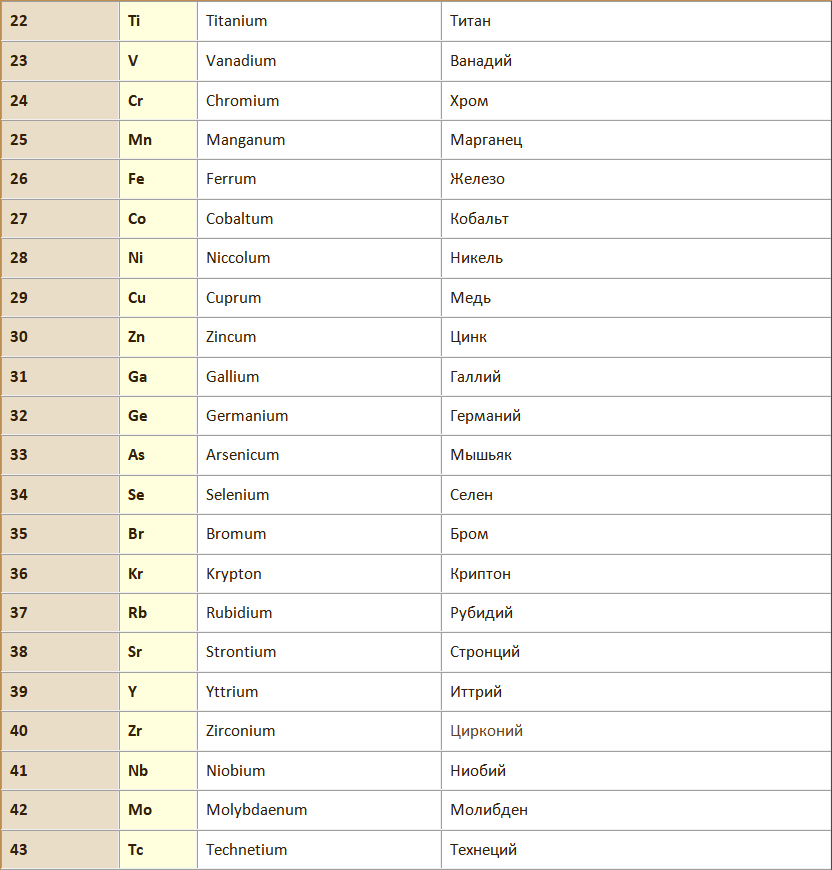
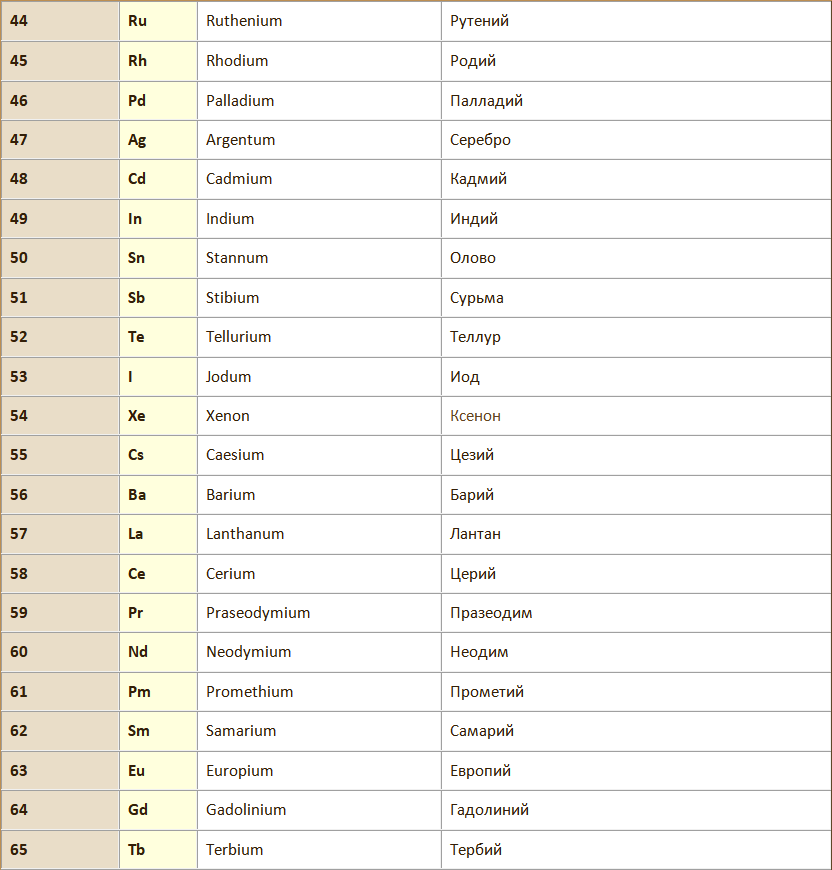
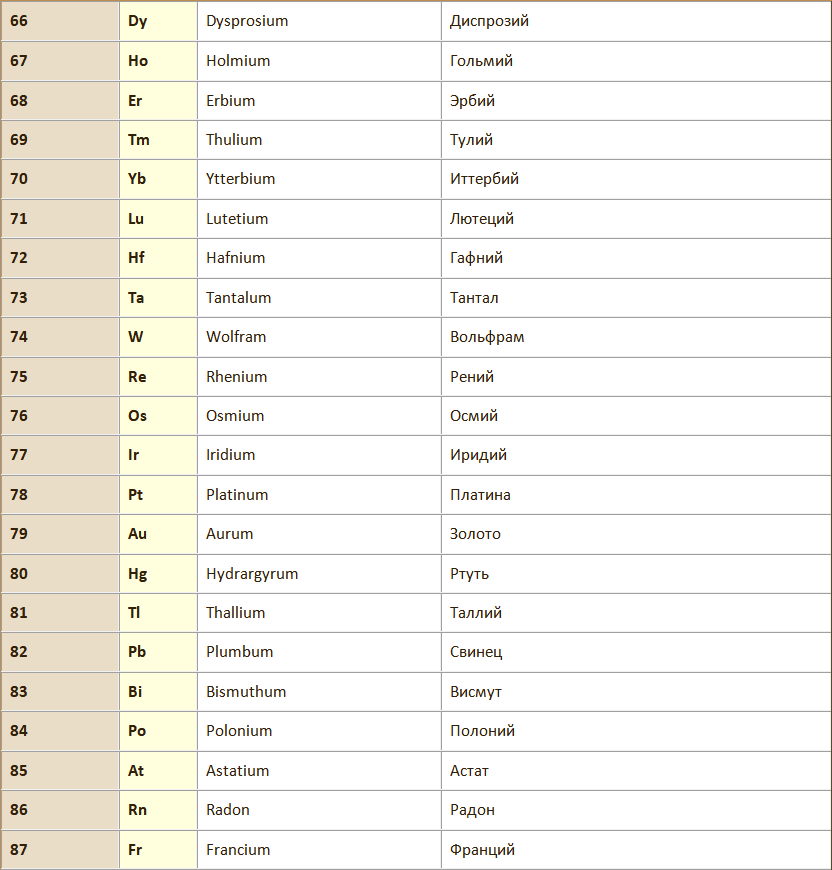
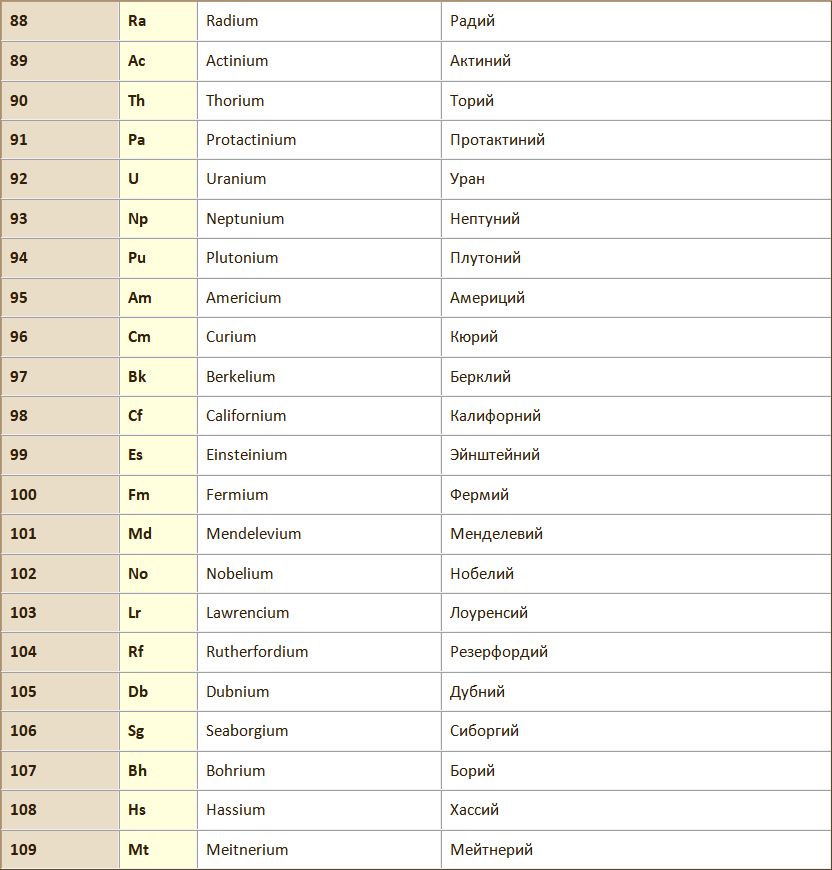
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Химические свойства атома определяются его строением.
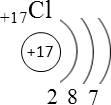
Молекула – наименьшая частица вещества, обладающая его химическими свойствами, которые определяютя её составом и химическим строением мощью химических формул, в которых атомы обозначаются символами химических элементов, а их количество подстрочными индексами.

Атомная масса (Аr) – относительная масса атома элемента, показывающая во сколько раз данный атом тяжелее 1/12 атома углерода, т.е. выраженная в дальтонах.
Молекулярная масса (Mr) – относительная масса молекулы вещества, выраженная в дальтонах. Молекулярная масса вещества равна сумме масс всех атомов, образующих молекулу или частицу.
Величиной, характеризующей число структурных единиц, является количество вещества. За единицу измерения количества вещества принят моль.
Моль – количество вещества n (либо ν (ню), содержащее столько структурных единиц, сколько содержится в 12 г изотопа 12С.
Молярная масса (M) – масса 1 моля вещества в граммах, равная отношению массы вещества (m) к соответствующему количеству вещества (n):
М = m/n
M численно равна молекулярной массе Mr.
NА – число Авогадро, которое соответствует числу структурных единиц в одном моле любого вещества. NА = 6,022 · 1023 1/моль.
Масса вещества (m), его количество и молярная масса между собой связаны соотношением:
m = n·М
Молярный объём газа (VM )
– объём, который занимает 1 моль газообразного вещества при данных условиях.
– это объем 1 моля газа, равный отношению объема газа (V) к количеству вещества (n).
При нормальных условиях (н.у.), т.е. при температуре 20 ◦ С и давлении 1 атм. (101,3 кПа), молярный объём газа (Vm) составляет 22,4 л/моль. При вычислении молярного объёма газа в других условиях используют уравнение состояния идеального газа:
P·V = n·R·T
(P – давление, V – объём газа, n – количество газа, Т – абсолютная температура,
R – универсальная газовая постоянная, значение которой 8,31 Дж/моль·K = 0,082057 л·атм·К⁻¹·моль⁻¹)
Эквивалент – реальная или условная часть формульной единицы (атома, молекулы или иона), принимающая участие в образовании одной химической связи при протекании химической реакции.
Под «реальной» частицей понимают реально существующие соединения (NaOH, H2SO4, H2O и др.), под «условной» частицей – доли этих реальных частиц 1/2 H2SO4). Например, в реакции NaOH + HCl = NaCl + H2O эквивалентом гидроксида натрия будет катион Na+ потому что при обмене он заменяется на катион водорода. То есть он эквивален H+.
Числo эквивалентности Z показывает, сколько эквивалентов вещества содержится в одной формульной единице. Значение Z зависит от химической реакции, в которой вещество принимает участие.
Наряду с числом эквивалентности часто используют понятие фактора эквивалентности f, представляющего собой долю формульной единицы, соответствующую эквиваленту f =1/Z.
Пример:
H2SO4+ 2NaOH = Na2SO4 + H2O
Z (H2SO4) = 2
Z (NaOH) = 1
В данной реакции одна молекула серной кислоты, отщепляя 2 катиона водорода, расходует две химических связи на образование средней соли Na2SO4, т.е. 1 молекула серной кислоты содержит 2 эквивалента. Число эквивалентности Z = 2, а эквивалентом серной кислоты является ½ молекулы, т.е. фактор эквивалентности f = ½.
H2SO4+ NaOH = NaHSO4 + H2O
Z (H2SO4) = 1
Z (NaOH) = 1
При образовании кислой соли NaНSO4 в молекуле серной кислоты замещается на натрий только один атом водорода, поэтому в данной реакции эквивалентом серной кислоты является вся молекула.
Примечание:
А) В химических реакциях обменного типа число эквивалентности считают равным количеству моль Н+ или ОН¯ ионов, которые отщепляются или присоединяются 1 молем вещества.
В) В окислительно-восстановительных реакциях (ОВР) число эквивалентности рассчитывается по отношению к количеству отданных или принятых частицей электронов. Количество эквивалентов вещества νЭ прямо пропорционально произведению количества моль вещества и числа эквивалентности: νЭ = Z · ν
Молярная масса эквивалента (эквивалентная масса) МЭ равна массе одного моль эквивалента вещества. [MЭ]= 1 г/моль
Молярная масса эквивалента МЭ (размерность г/моль)– равна массе вещества, эквивалентной 1 молю водорода или 1 молю электронов в химической реакции. Численно равна эквиваленту вещества. МЭ равна молярной массе вещества, умноженной на фактор эквивалентности:
М(1/z X) = M(X) • fэкв (X) = M(X) / z
Основные законы химии:1. Закон сохранения массы (Михаил Васильевич Ломоносов, 1756 и Антуан Лоран Лавуазье, 1778)
Масса исходных веществ, вступивших в реакцию, равна массе получившихся веществ.
2. Закон эквивалентов (И. В. Рихтер, 1792 и У. Х. Волластон, 1807)
Отношение масс веществ, вступающих в химическое взаимодействие, равно отношению их химических эквивалентов
3. Закон постоянства состава (Жозеф Луи Пруст, 1799г.).
Состав индивидуального химического соединения постоянен и не зависит от способа получения этого соединения.
4. Закон простых кратных отношений. (Джон Дальтон, 1803г.). Если два элемента образуют между собой несколько соединений, то на одну и ту же массу одного элемента приходятся такие массы другого, которые относятся друг к другу, как небольшие целые числа.
5. Закон простых объёмных отношений (Жозеф Луи Гей Люссак, 1808).
Объёмы реагирующих газов относятся друг к другу и к объёмам газообразных продуктов как небольшие целые числа.
6. Закон Авогадро (Амедео Авогадро, 1810г.; Канниццаро, 1860г.).
В равных объёмах газов при одинаковых условиях содержится одинаковое число молекул.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯЗАДАНИЕ 1
Как проанализировать образец воды и убедиться, что она чистая или содержит примеси?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 2. Приведите по 2 примера веществ, являющихся при 20 градусах Цельсия: а) газами б) жидкостями в) твердыми
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 3. Приведите примеры смесей: а) двух газов, б) 2 жидкостей в) твердого и жидкого вещества г) газа и жидкости
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 4. Как очистить кукурузную крупу от соли и соевое масло от воды?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 5. В чем сходство и различие очистки веществ фильтрованием и отстаиванием?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 6. В чем заключается очистка веществ перегонкой? Какое оборудование необходимо иметь в лаборатории для проведения перегонки?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 7. Что называют экстракцией? Какое оборудование необходимо иметь в лаборатории для проведения экстракции?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 8. Назовите 5 любых веществ и область их применения. Какие из них используются в медицине?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 9. Приведите 3 примера, как чистое вещество превращается в смесь. Какие смеси используются в медицине?
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 10. Будет ли смешиваться с водой (образовывать однородную жидкость, растворяться): а) спирт б) ацетат натрия (соль) в) бензин г) подсолнечное масло д) серная кислота
Решение:
_____________________________________
_____________________________________
ЗАДАНИЕ 11. Напишите формулы 3 веществ, относительные молекулярные массы которых кратны а) 3 б) 4
ЗАДАНИЕ 12. Определите валентность центрального атома в соединениях: а) азотистая кислота б) фосфорная кислота в) перманганат калия г) хромат калия д) карбонат натрия
ЗАДАНИЕ 13. В каком из оксидов марганца самая высокая массовая доля кислорода : MnO, Mn2O3, MnO2, Mn3O4, Mn2O7 Ответ подтвердите расчетом.
ЗАДАНИЕ 14. В каких соединениях CuS, FeS2, SO2, SO3, CS2 – массовые доли серы составляют 33%; 3%; 40%; 50%; 53%; 84,2%?
ЗАДАНИЕ 15. Какого металла больше по массе в медном колчедане CuFeS2 (меди или железа)?
Определите формулу химического соединения по данным элементного анализа:
А) w (H)= 1,46% ; w (Cl) =51,82%; w(O)= 46,72% (Ответ: HClO2)
Б) w(K)= 39,7%; w(Mn)=27,9%; w(O)=32,4% (Ответ: K2MnO4)
ЗАДАНИЕ 16. С какой массой преципитата CaHPO4 в почву будет внесено столько же фосфора, сколько его вносится с 620 кг фосфорита Ca3(PO4)2 (Ответ: 544 кг)
ЗАДАНИЕ 17. Гормон инсулин имеет Mr = 5734. Вычислите массу одной молекулы инсулина в граммах.
ЗАДАНИЕ 18. Масса молекулы хлорофилла равна 1,485 ·10 -18 мг. Вычислите молярную массу хлорофилла.
ЗАДАНИЕ 19. Как называют силы, удерживающие атомы в химических соединениях? Какова природа сил химической связи?
ЗАДАНИЕ 20. Для соединений каких классов веществ характерна ионная связь?
ЗАДАНИЕ 21. Какое строение – молекулярное или ионное – имеют вещества с ковалентной связью?
ЗАДАНИЕ 22. Определите тип химической связи в следующих соединениях:
H2, KCl, NH3, CaBr2, CH4, N2, NCl3, LiOH, SF6.
ЗАДАНИЕ 23. Укажите виды химических связей в следующих веществах и их смесях (сплавах):
латунь (сплав меди и цинка), хлор, вода, фтороводород, графит (углерод), метан, серная кислота, углекислый газ.
ЗАДАНИЕ 24. Как изменится длина химический связи водород-галоген в ряду: H-Cl, H-Br, H-I?
ЗАДАНИЕ 25. На основании физических характеристик определите, какое строение имеет вещество – ионное или молекулярное:
t пл = 2800 ´C (MgO)
t кип = 84´C, резкий запах (HNO3)
t пл = 801 ´C (NaCl)
t кип = – 84,8´C, резкий запах (HCl)
t кип = – 252,6´C (H2)
ЗАДАНИЕ 26. Напишите структурные (графические) формулы веществ:
HCl, H2S, PCl3, CF4, N2O3
ЗАДАНИЕ 27. Карбиды CaC2, Al4C3 и нитриды Mg3N2, AlN – это вещества с ионной связью. Определите в каком из них наибольшая массовая доля металла, рассчитайте ее значение.
ЗАДАНИЕ 28. У атомов каких химических элементов электроотрицательность выше: лития или углерода, брома или азота, серы или хлора?
ЗАДАНИЕ 29. К атомам каких элементов смещены общие электронные пары в молекулах: HI, CO, N2H4, SiCl4?
ЗАДАНИЕ 30. Назовите 4 типа кристаллических решеток (КР), различающихся характером частиц в узлах?
Сгруппируйте по типам кристаллических решеток (КР) следующие вещества: O2, C, CaC2, Si, Pb, CuO, H2O, CO2, Al.
Часть 2. Практическая работа
«Агрегатные состояния вещества. Кристаллические решётки»
1. К твёрдым углеводородам неорганического происхождения, обладающих структурой ионных кристаллов относят шунгит и керит (фиброкерит). Опишите их структуру и ответьте на вопрос, можно ли эти вещества отнести к предбиологическим системам.
Решение:
_____________________________________
_____________________________________
2. Биологические кристаллы построены из биологических макромолекул – белков, нуклеиновых кислот или вирусных частиц. Вследствие больших размеров биологических макромолекул, содержащих 103–104 атомов, биологические кристаллы имеют очень большие (по сравнению с обычными кристаллами) периоды кристаллической решётки (50–200 Å), а у вирусов они достигают 1000Å и более. Биологические кристаллы образуются иногда в живых организмах – in vivo, однако главным методом их получения является кристаллизация выделенных из живых организмов и тщательно очищенных белков и других биологических макромолекул.
Проанализируйте электронно-микроскопические фотографии упаковки молекул в кристаллах белков каталазы, вируса некроза табака и кристаллов белка из микроорганизмов Bacillus thwingiensis. Какие особенности вы можете заметить в них (см. рис.)?

3. Заполните таблицу «Кристаллические образования, присутствующие в различных тканях». Опишите структуру решетки неорганических кристаллов костной ткани.

Обсуждение и комментарии:
_____________________________________
_____________________________________
4. Гидроксиапатит (гидроксилапатит) – основной кристалл минерализованных тканей; составляет 95–97% в эмали зуба, 70–75% в дентине и 60–70% в костной ткани. Зарисуйте простанственную структуру кристалла гидроксиапатита Ca10(PO4)6(OH)2, учитывая, что гидроксильные группы расположены вдоль гексагональной оси, тогда как фосфатные группы, имеющие наибольшие размеры по сравнению с ионами кальция и гидроксилами, распределяются как равнобедренные треугольники вокруг гексагональной оси.
Решение:
5. Скелет одноклеточных радиолярий и многоклеточных губок образован «органоминеральным» кристаллическим веществом, состоящим на 20–30 процентов из органических соединений, а в остальном из минерального кристалла. В индивидуальном развитии такого организма идет процесс минерализации – замещения биомолекул минералом, причем законы кристаллографии и биохимии здесь тесно переплетены.
Предположите химический состав скелета радиолярий.
Решение:
_____________________________________
_____________________________________
6. В организме человека, в лекарственных препаратах большинство d – элементов образуют комплексные соединения: Fe – гемоглобин, Zn – ферменты карбоангидраза и алкогольдегидрогеназа, Cu – цитохромоксидаза, Mn – пируваткарбоксилаза, Mg – хлорофилл, Co – витамин В12.
Опишите, по какому принципу построены эти вещества.
Обсуждение и комментарии:
_____________________________________
_____________________________________
7. Соединения железа используют при лечении железодефицитных анемий (фероцены), цинка – в дерматологии, хелатные комплексы (комплексоны) используют как антиоксиданты и антидоты для звязывания тяжелых металлов при отравлениях.
Среди комплексонов наиболее распространены соли этилендиаминтетрауксусной кислоты (ЭДТА), прежде всего этилендиаминтетраацетат натрия. Опишите антидоты – комплексоны (комплексообразователи), которые образуют прочные комплексные соединения с токсичными катионами Hg, Co, Cd, Pb . Каков механизм их действия?
Обсуждение и комментарии:
_____________________________________
_____________________________________
Часть 3. Лабораторная работа
«Определение физических свойств химических веществ»
Перечень образцов для анализа:
Ментол, салициловая кислота, сульфосалициловая кислота, глицин, сахароза, нитрат кобальта, медный купорос, железный купорос
ПРОТОКОЛ ОФОРМЛЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫДата ______________________
Номер образца_____________
Физические характеристики и физические константы образца:

Физико-химические характеристики:

Микрокристаллоскопия
(рассмотреть кристаллы под микроскопом, нарисовать рисунок)
Выводы: _____________________________________
Часть 4. Домашнее задание
1. Продумайте план анализа неизвестного химического вещества. Составьте предполагаемый план анализа
Физические характеристики:
1. Цвет
2. Запах
3. Характер кристаллов (для тв. веществ)
Физические константы (Tпл., Ткип., плотность и др.)
Способность растворяться:
– в воде
– в спирте
– в неполярных органических растворителях
Химическая природа вещества (неорганическое/ органическое)
Тест на обугливание
Химические свойства
Количественный анализ
Выводы:
2. Составьте план анализа для таких веществ как хлорид натрия, сульфат магния, ментол, аскорбиновая кислота, ацетилсалициловая кислота
3. Перечень вопросов для самостоятельной проработки:
1. Что является предметом изучения химии?
2. Сформулируйте основные стехиометрические законы.
3. Дайте определения понятиям: химический элемент, атом, молекула, эквивалент.
4. В каких единицах измеряется атомная масса? Сколько граммов в 1 а.е.м.?
5. В каких единицах измеряется количество вещества? Приведите значение числа Авогадро. В чём его физический смысл?
6. Как вычисляют молекулярную массу? Что такое молярная масса и молярная масса эквивалента (эквивалентная масса)?
7. Что такое молярный объём газа? Какой объём занимает 1 моль газа при н.у.?
8. Вычислите молярную массу веществ: CaCO3, CH3COOH, H2C2O4·2H2O. Последняя формула соответствует кристаллогидрату щавелевой кислоты, в котором на одну молекулу кислоты приходится две молекулы воды.
9. Как масса вещества связана с его количеством? Сколько моль вещества содержится в 53 г H2CO3, 180 г H2O, 56 л N2 при н.у.?
10. Вспомните формулы для расчёта молярной массы эквивалента веществ. Вычислите эквивалентные массы веществ: H3ВO3, Ba(OH)2, CuSO4
11. С какой массой калиевой селитры KNO3 в почву будет внесено столько же азота, сколько его вносится с 396 кг (NH4)2SO4 (Ответ: 606 кг)
12. Рассчитайте эквивалентную массу серной кислоты, гидроксида кальция и сульфата алюминия.
13. Определите эквивалент и эквивалентную массу фосфорной кислоты в реакции с гидроксидом кальция, в которой в качестве продукта присутствует кислая соль – гидрофосфат кальция.
14. Определите эквивалент и эквивалентную массу гидроксида висмута в реакции, продуктом которой является средняя соль – хлорид висмута.
15. Что является эквивалентом лития, бериллия, бора и углерода в их гидридах.
16. Определите эквивалентную массу различных оксидов хрома.
1.2. Химические реакции. Принципы качественного и количественного анализа веществ
Часть 1. Теоретическое введение
1.1. Теория химического строения веществГлавная роль в создании, обосновании и подтверждении теории химического строения принадлежит русскому химику Александру Михайловичу Бутлерову (1861г.), хотя кроме него элементы этой теории начали разрабатывать А. Купер в Англии и А. Кекуле в Германии.
Основные положения теории химического строения А. М.Бутлерова:
• Молекулы имеют определенное химическое строение, под которым подразумевают порядок связей атомов в молекуле.