
Каталитический риформинг бензинов. Теория и практика
Вследствие небольшого различия в энергиях s– и p-атомных орбиталей происходит гибридизация АО, в результате образуется одна гибридная sp-зона, как показано ниже (рис. 25).
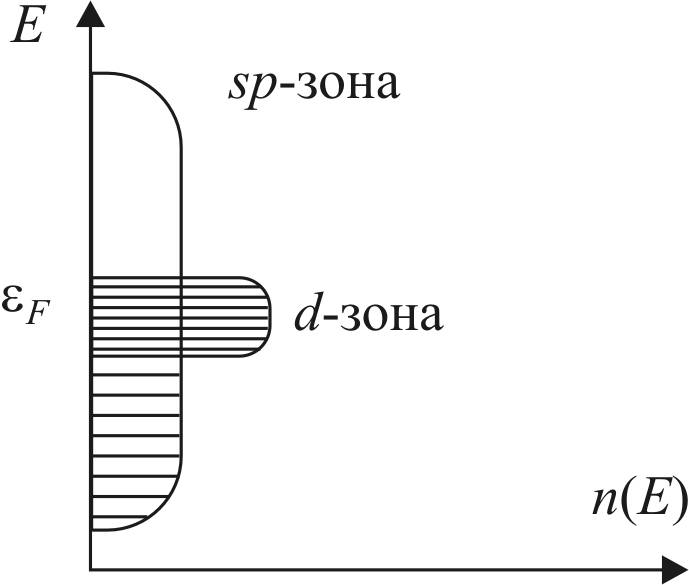
Рис. 25. Схема образования sp– и d-зон металла
50%-ный s-характер sp-орбиталей обеспечивает сильное перекрывание и расщепление энергетических уровней образующихся орбиталей, что приводит к формированию широкой зоны, правда, с маленькой плотностью электронных состояний из-за ограниченного количества s и p-электронов – максимум два электрона на атом переходного металла. Sp-зона играет важную роль в начальном взаимодействии молекулы с поверхностью, обеспечивая снижение энергии адсорбата, однако это взаимодействие не приводит к расщеплению энергетических уровней и активации молекулы и не является причиной различий каталитических свойств металлов. Эти различия обусловлены структурой d-зон переходных металлов.
В формировании d-зоны участвуют все пять атомных d-орбиталей, каждая из которых образует свою зону, состоящую из набора связующих, несвязующих и разрыхляющих орбиталей.
Наибольшее расщепление с формированием зоны самой большой ширины происходит при образовании σ-связей, в котором по соображениям симметрии могут участвовать только dz2-орбитали.
Остальные d-орбитали участвуют в менее эффективном
π-связывании (dyz и dzx) и еще менее эффективном δ-связывании (dxy и dx2–y2).
Энергии связующих σ-, π-, δ-МО соотносятся как 1:0,8:0,1.
Схема образования σ-, π-, δ-МО-зон представлена на рис. 26.
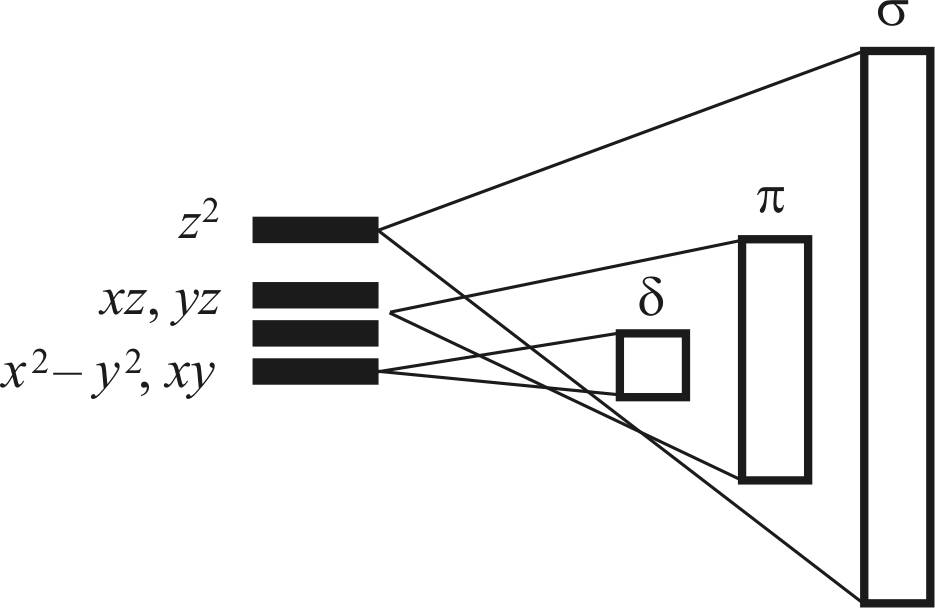
Рис. 26. Схема образования σ-, π-, δ-МО-зон [25]
Для наглядности уровни АО орбиталей разнесены. Фактически все они имеют одинаковый уровень энергии, так как являются вырожденными орбиталями с одинаковым главным квантовым числом n. В середине зоны находятся несвязывающие МО, уровень энергии которых близок к таковой атомных орбиталей. Ниже этого уровня находятся связующие МО, энергия которых увеличивается с ростом числа узловых плоскостей. Низ зоны занимают полностью связующие МО, не имеющие узловых плоскостей, разделяющих соседние атомы металла.
Связующие орбитали имеют низкий уровень энергии и являются аналогом внутренних электронов атома, не принимая участия в хемосорбции.
Верхняя часть зоны после несвязующих орбиталей занята разрыхляющими орбиталями, которые, по существу, и представляют собой валентные электроны металла, ответственные за формирование хемосорбционных связей с молекулами адсорбата.
Самые верхние орбитали зоны представлены полностью разрыхляющими σ- и π-орбиталями, образованными dz2-, dxz- и dyz-атомными орбиталями.
Молекулярные орбитали, образованные x2–y2 и xy–АО, находятся в центральной части зоны и не участвуют в хемосорбции.
Разница в энергиях самой верхней и самой нижней МО называется шириной зоны и вычисляется по формуле
W = En – E1.
Важной характеристикой зоны является плотность состояний ρ – это отношение числа энергетических уровней в интервале энергии ΔЕ к этому интервалу. Максимальная плотность состояний достигается в центральной части зоны, минимальная – на краях зоны, где существует единственный способ образования полностью разрыхляющих и полностью связующих орбиталей.
Заполнение зоны происходит в соответствии с принципом Паули, то есть на каждой молекулярной орбитали независимо от ее протяженности может находиться максимум два электрона. Степень заполнения зоны зависит от количества d-электронов атома. Верхний уровень энергии, занятых МО при температуре 0 К, носит название уровня Ферми (εf).
При Т > 0 электроны занимают более высокие уровни,
и заселенность орбиталей определяется распределением Ферми – Дирака.
Очевидно, что энергия орбиталей, находящихся выше середины зоны, будет ближе к уровням акцепторных орбиталей молекул, чем у орбиталей свободных атомов металла.
Таким образом, образование d-зоны обеспечивает более сильное дативное взаимодействие, которое увеличивается при подъеме уровня Ферми.
Компактность d-зоны и высокая плотность состояний позволяют рассматривать d-зону как одну молекулярную орбиталь, взаимодействующую с молекулой адсорбата с образованием связующей и разрыхляющей орбиталей. Подробное описание модели сильной связи приведено в [26; 54].
Современные представления об образовании химической связи между адсорбатом и поверхностью d-металла разработаны Хофманом и доступно изложены в его книге [25].
Рассмотрим, что происходит, когда молекула адсорбата, в нашем случае молекула СО, подходит к поверхности переходного металла.
Электронная структура молекулы рассмотрена ранее. Верхней заполненной орбиталью в молекуле является 3σ.
Эта орбиталь в основном локализована на атоме углерода и может рассматриваться как неподеленная электронная пара
углеродного атома. Указанные свойства 3σ-МО позволяют участвовать в образовании σ-связи с молекулярными орбиталями аналогичной симметрии, локализованными в верхней части d-зоны переходного металла. Такими МО являются орбитали, образованные из атомных dz2.
Вакантной орбиталью с самой низкой энергией в молекуле СО является разрыхляющая 2π-МО. 2π-орбиталь имеет узловую плоскость и способна к π-перекрыванию с МО d-зоны, которые образованы атомными орбиталями dxz и dyz, также имеющими узловую плоскость.
Особенностью 2π-орбитали является неравномерное распределение электронной плотности в лепестках орбитали.
Поскольку большая часть электронной плотности сконцентрирована в лепестке орбитали, локализованном у атома углерода, то максимальное перекрытие с орбиталями металла достигается в случае, когда приближающаяся молекула СО своей осью ориентирована перпендикулярно поверхности металла.
Схема взаимодействия орбиталей молекулы и металла при образовании донорно-акцепторной и дативной связи представлена на рис. 27.
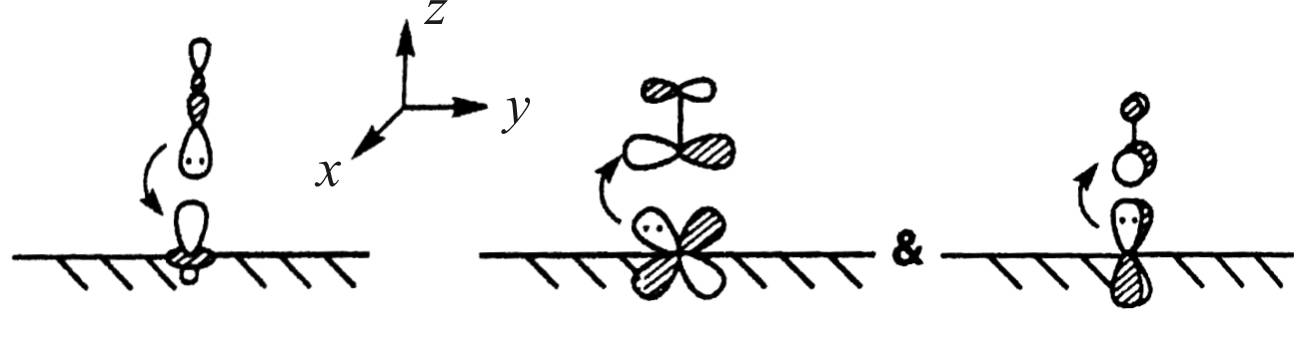
Рис. 27. Схема взаимодействия орбиталей молекулы и металла
при образовании донорно-акцепторной и дативной связи
Существенным при рассмотрении взаимодействия является то, что 3σ-МО имеет уровень энергии ниже уровня Ферми и поэтому может перекрываться только с заполненными dz2-орбиталями металла.
При приближении молекулы к поверхности возникает взаимодействие между 3σ-орбиталью и заполненными орбиталями d-зоны, которое приводит к расщеплению исходных уровней энергии с образованием двух новых энергетических уровней, соответствующих связующей и разрыхляющей орбиталям.
Поскольку это взаимодействие заполненных орбиталей, то новые орбитали будут также заполнены (рис. 28).
В случае взаимодействия молекул нетто-результат 4-электронного 2-орбитального взаимодействия однозначен – отсутствие связывания из-за заполнения образующейся разрыхляющей орбитали. При взаимодействии с d-зоной этот результат зависит от того, насколько сильным будет расщепление уровней энергии. Чем ближе уровни энергии орбиталей и чем ближе молекула подходит к поверхности, тем больше интеграл перекрывания орбиталей и энергия стабилизации, определяющая расщепление.
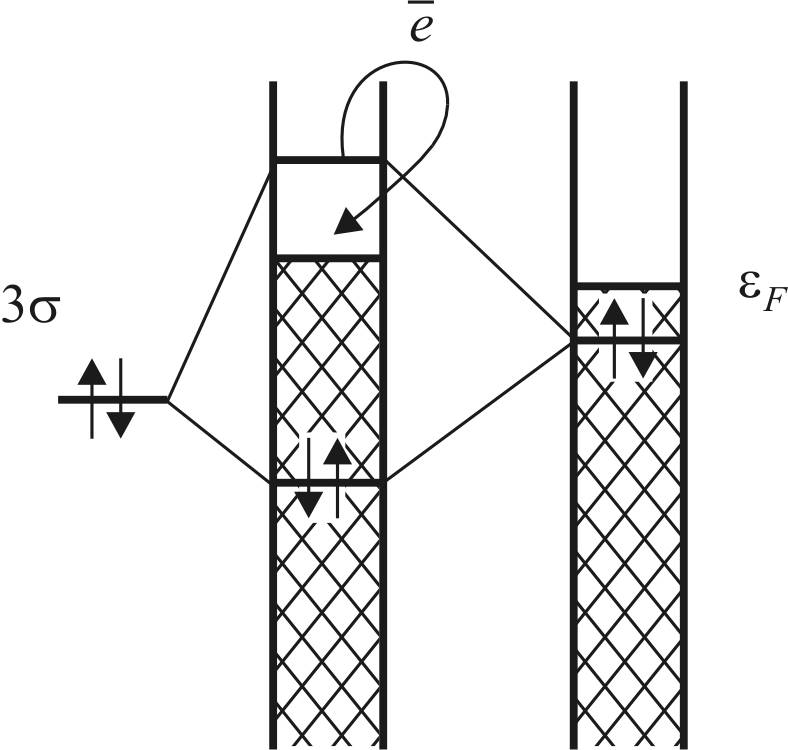
Рис. 28. Взаимодействие 3σ-орбиталей
и электронной d-зоны [25]
При достаточно сильном расщеплении уровень новой разрыхляющей орбитали достигает уровня Ферми, и тогда электроны с этой орбитали могут быть сброшены в d-зону, где они займут пустые уровни.
Рассмотренные 4-электронные взаимодействия показаны на рис. 29, где а соответствует взаимодействию двух молекул, б – молекулы с поверхностью металла.
Эти пустые орбитали локализованы на поверхности металла и являются разрыхляющими орбиталями. Заполнение их приводит к ослаблению связей между поверхностными атомами металла и является причиной часто наблюдаемой реконструкции поверхности при хемосорбции.
В результате взаимодействие в системе «молекула – поверхность» из отталкивающего переходит в связующее с образованием связи молекулы с металлом.

Рис. 29. Схема 4-электронных взаимодействий:
а – двух молекул; б – молекулы с поверхности металла [25]
Расчеты с использованием расширенного метода Хюккеля для адсорбции СО на поверхности никеля показывают, что молекула СО теряет 0,38 электрона. В итоге заселенность 3σ-орбитали снижается с 2,0 до 1,62.
Выигрыш энергии при образовании связи зависит от параметров d-зоны металла и пропорционален выражению
,
где f – степень заполнения d-зоны; εd и ε3σ – уровни энергии центра d-зоны и 3σ-орбитали молекулы СО; β – резонансный интеграл [26].
Как следует из данного выражения, выигрыш энергии увеличивается при сближении уровней энергии орбиталей и уменьшения степени заполнения d-зоны.
Схема образования дативной π-связи представлена на рис. 30.
Поскольку уровень энергии 2π-орбитали выше уровня Ферми, то максимальное расщепление будет наблюдаться в случае перекрывания орбитали с одной из вакантных МО d-зоны, расположенной над уровнем Ферми.
Заметим, что при взаимодействии молекул новые орбитали останутся незаполненными, и связь не образуется. В случае связывания молекулы с поверхностью металла d-зона играет роль резервуара, из которого происходит заполнение меньшей по энергии орбитали с образованием химической связи. При этом на разрыхляющую орбиталь молекулы СО поступает 0,74 электрона. Расчеты показывают, что эти электроны поступают на 2π-орбиталь с внутренних xz- и yz-орбиталей зоны, при этом эти донорные орбитали не остаются пустыми, а заполняются электронами с поверхности металла.
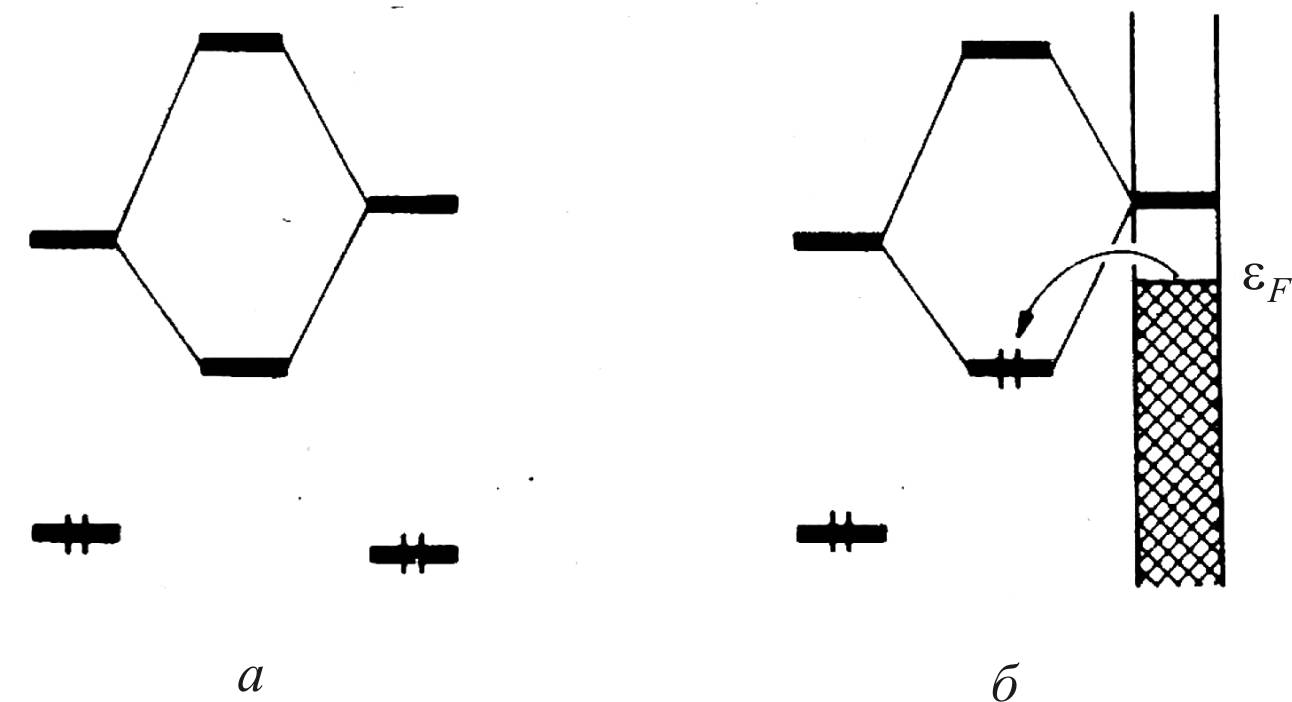
Рис. 30. Образование дативной π-связи:
а – эффект отсутствует; б – притяжение [25]
Выигрыш энергии при формировании дативной связи зависит от параметров d-зоны металла и пропорционален выражению
,
где ε2π – уровень энергии 2π-орбитали молекулы СО; β – резонансный интеграл [26].
Из этого выражения еще раз следует, что выигрыш энергии при образовании дативной связи увеличивается при сближении уровней энергий орбиталей металла и адсорбата и возрастания степени заполнения d-зоны.
Суммарным результатом рассмотренных взаимодействий является образование хемосорбционной связи молекулы с поверхностью металла и ослабление связей в молекуле и в металле (компенсационный эффект хемосорбции по Хофману).
Ослабление связи активирует молекулу, снижает энергию активации и является причиной каталитического действия d-металлов.
Для d-металлов, расположенных в правой части периода, образование σ-связи в большинстве случаев является второстепенным фактором активации адсорбируемой молекулы в связи с более полным заполнением зоны, основным же является образование дативной связи.
Как было показано в предыдущем рассмотрении хемосорбции молекулы СО на никеле, вакантная орбиталь адсорбата имеет более высокую энергию, чем уровень Ферми. Это справедливо и для других молекул, включая углеводороды.
В связи с этим подъем уровня Ферми приводит к сближению энергий перекрывающихся орбиталей металла и адсорбата и, следовательно, к образованию более прочной адсорбционной связи и более сильному ослаблению связи в молекуле.
Понижение уровня Ферми будет приводить к обратному результату.
Закономерности изменения характеристик d-зон переходных металлов рассмотрены ниже.
Квантово-механические расчеты положения уровня Ферми для металлов первой переходной серии (3d-металлы) проведены впервые О. Андерсеном (рис. 31).
Описание происходящих изменений приведено по [25]: центр d-зоны и уровень Ферми при смещении вправо по переходному периоду опускаются в связи с увеличением положительного заряда атомного ядра.
Поскольку атомные d-орбитали становятся компактнее, то это приводит к уменьшению степени перекрывания, приводящему к сужению зоны. В то же время увеличивается заполнение зоны, что поднимает уровень Ферми. В конечном счете первый фактор перевешивает, что приводит к опусканию уровня Ферми.

Рис. 31. Энергетические уровни d-зоны металлов
первого переходного периодов
Полученные закономерности справедливы и для металлов второй и третьей переходных серий d-металлов, а также при перемещении внутри группы сверху вниз, что представлено на графике ниже для положения центра d-зоны [26].
Как следует из рис. 32, центр зоны смещается вниз внутри периода при движении слева направо и при перемещении вниз внутри группы.

Рис. 32. Положение центра d-зоны для трех серий переходных металлов. Заметим, что центр d-зоны смещается вниз при движении вправо
по Периодической таблице. При полном заполнении d-зоны смещение ее центра вниз продолжается, и она превращается во внутренний уровень, не влияющий на химическое поведение металла [26]
При переходе от 4d-металлов к 5d-металлам наблюдается небольшое изменение по сравнению с переходом от 3d-металлов, причиной которого является заполнение f-AO, происходящее на этом переходе.
Слабое экранирование ядерного заряда f-электронами приводит к лантаноидному сжатию в третьем переходном периоде.
Атомные, ковалентные и ионные радиусы 5d-металлов лишь немногим больше, чем у 4d-металлов, несмотря на увеличение электронной оболочки на 14 электронов.
С учетом изложенного следует важный для понимания гетерогенного катализа вывод о том, что энергия связывания адсорбата с поверхностью металла и, следовательно, степень активации молекулы уменьшаются в периоде слева направо и по группе сверху вниз. Так, металлы, расположенные в левой части переходного периода, такие как железо, рутений и уран (6d-элемент), способны активировать такую прочную и инертную молекулу, как N2, и являются катализаторами синтеза аммиака.
Fe, Co и Ru адсорбируют СО диссоциативно и являются катализаторами синтеза Фишера – Тропша, проходящем через образование и гидрирование С-фрагментов.
В отличие от них, Pd, Pt, Ir и Cu адсорбируют СО без диссоциации и не могут быть катализаторами этого процесса.
В ряде случаев это может быть преимуществом. Например, при синтезе метанола, где диссоциация СО не требуется, меднохромовые катализаторы нашли широкое промышленное применение и являются основными катализаторами получения метилового спирта.
Платина находится внизу группы и в конце третьего переходного периода. Оба фактора приводят к понижению уровня Ферми и обусловливают более слабое связывание с молекулами адсорбата и, следовательно, более низкую активность платины в активации реагентов по сравнению с другими переходными металлами. К примеру, никель является более активным катализатором в реакциях дегидрирования циклогексана и гидрогенолиза н-гексана, причем активность в последней реакции выше, чем в дегидрировании.
Фактором, дополнительно понижающим активность платины, является практически полное заполнение зоны, что ограничивает образование σ-связей с молекулами-донорами электронов и не позволяет реализовать синергизм, возникающий при π- и σ-взаимодействии. Однако это не означает, что платина является не лучшим выбором в качестве катализатора риформинга. Для ответа на этот вопрос необходимо рассмотреть такие не менее важные характеристики катализатора, как селективность, стабильность и чувствительность к отравлению.
Не секрет, что гетерогенные катализаторы имеют худшую селективность по сравнению с гомогенными катализаторами, что обусловлено неоднородностью поверхности и существованием на ней различных реакционных центров. В связи с этим на гетерогенных катализаторах проходят как целевые, так и побочные реакции реагентов.
Селективность металлической функции катализатора риформинга – это его способность осуществлять основные реакции дегидрирования-гидрирования без заметного протекания побочной реакции гидрогенолиза углерод-углеродной связи, которая приводит к снижению выхода С5+ и водорода.
Упрочнение дативной σ-связи при использовании более активных переходных металлов ускоряет оба превращения, но гидрогенолиз сильнее и, таким образом, приводит к снижению селективности. Так, к примеру, никель по сравнению с платиной является более активным катализатором в реакциях дегидрирования циклогексана и гидрогенолиза н-гексана, причем активность в последней реакции выше, чем в дегидрировании.
В качестве другого примера ниже приведены данные Синфельта [36] по активности и селективности конверсии метилциклопентана, полученные на монометаллических катализаторах Pt/Al2O3 и Ir/Al2O3 с одинаковым содержанием металла. Иридиевый катализатор является значительно более стабильным и за счет этого обеспечивает более высокую конверсию МЦП, однако имеет худшую селективность по бензолу (39 % против 66 % на платине) в связи с повышенной активностью в гидрогенолизе.
Композиции Ir/Al2O3 были запатентованы в 1972 и 1975 годах, однако промышленное внедрение нового процесса, разработанного как конкурента платформинга, так и не состоялось, и позднее был внедрен менее радикальный вариант платиноиридиевого катализатора с улучшенной селективностью.
Платина обеспечивает лучшее сочетание активности и селективности по сравнению с другими металлами. Определенная гидрогенолизующая активность платины даже полезна и необходима, так как позволяет контролировать молекулярную массу олигомеров и предотвращать образование графитизированных отложений на поверхности кластеров активного металла, которые являются основной причиной снижения стабильности катализатора.
Чувствительность катализатора к отравлению сероводородом также связана с прочностью дативной связи, образуемой между металлом и атомом серы.
Сильное связывание, реализуемое с Re, Ir, Ni или Pd, дезактивирует металлическую функцию катализатора, слабое связывание минимизирует ингибирующий эффект сероводорода.
Указанные преимущества позволяют понять причины столь долгого сохранения монопольного положения платины как базового металла катализатора риформинга.
Принцип Сабатье и вулканообразные кривые Баландина. Принцип Сабатье устанавливает качественный критерий для того, чтобы та или иная субстанция могла быть хорошим катализатором химической реакции.
По Сабатье взаимодействие субстанции и субстрата должно быть just right, в самый раз, то есть и не очень слабым, и не очень сильным.
При очень слабом взаимодействии субстрат не образует связи с катализатором, и каталитической реакции не происходит.
При очень сильном взаимодействии продукт реакции остается связанным с катализатором.
Баландин сформулировал принцип энергетического соответствия, продемонстрированный на примере разложения муравьиной кислоты на различных переходных металлах.
Баландин показал, что при изменении энтальпии образования формиата металла, являющегося промежуточным веществом в реакции разложения, скорость реакции проходит через максимум. График такой зависимости имеет вулканообразную форму. При небольших значениях энтальпии образования скорость реакции низкая, поскольку адсорбция муравьиной кислоты является лимитирующей стадией превращения. При высоких значениях энтальпии лимитирующей становится десорбция продуктов разложения. Максимум скорости соответствует промежуточному значению энтальпии, достигаемому на платине и иридии.
В настоящее время разработаны расчетные методы построения вулканообразных кривых, основанные на применении известного соотношения Бренстеда – Эванса – Поляни (БЭП), предложенного ранее для гомогенных реакций.
Соотношение представляет линейную зависимость энергии активации элементарной стадии от теплоты реакции
Еа = Ео + αΔН,
где Ео – константа; α – коэффициент, принимающий значения от нуля до единицы и зависящий от структуры переходного состояния реакции; α приближается к единице для реакций, для которых характерно позднее переходное состояние со структурой, близкой к продукту реакции.
В соответствии с данным соотношением энергия активации эндотермической реакции, имеющей позднее переходное состояние, увеличивается при возрастании теплового эффекта.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Вы ознакомились с фрагментом книги.
Для бесплатного чтения открыта только часть текста.
Приобретайте полный текст книги у нашего партнера:
Всего 10 форматов