
Внутренние болезни. Том 1
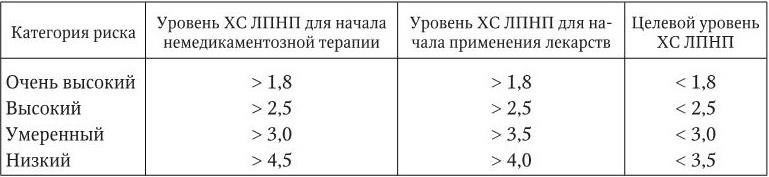
Таблица 1.4
Уровни ХС ЛПНП для определения тактики лечения больных и целевые уровни ХС ЛПНП в зависимости от категории риска (ммоль/л)
К медикаментозным средствам коррекции нарушений липидного обмена относятся: ингибиторы ГМГ-КоА-редуктазы (статины), эзетимиб, секвестранты желчных кислот (ионно-обменные смолы), производные фиброевой кислоты (фибраты), никотиновая кислота (ниацин) и омега-3-полиненасыщенные жирные кислоты.
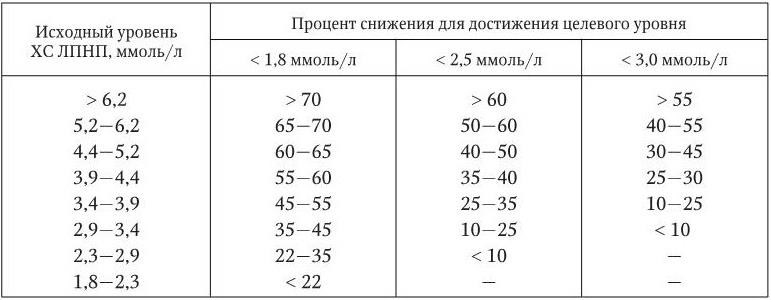
Таблица 1.5
Снижение уровня ХС ЛПНП, необходимое для достижения целевого уровня (% от исходного)
Статины. В основе механизма действия статинов лежит ингибирование ключевого фермента начальных этапов синтеза ХС – ГМГ-КоА-редуктазы. При снижении активности этого фермента возникает кратковременный внутриклеточный дефицит ХС. Вследствие этого гепатоциты экспрессируют повышенное количество рецепторов ЛПНП, что приводит к увеличению захвата ХС ЛПНП из плазмы крови. Одновременно из-за изменения соотношения промежуточных форм липопротеидов происходит умеренное снижение уровня ТГ, а в связи с этим и некоторое повышение уровня ЛПВП. Помимо влияния на липидный спектр крови, статины обладают рядом дополнительных (плейотропных) эффектов, основными из которых являются: подавление синтеза медиаторов воспаления, улучшение функции эндотелия, предупреждение окислительной модификации ЛПНП, стабилизация фиброзной капсулы атеросклеротической бляшки, антитромбогенное действие. Статины применяются для лечения больных с гиперлипидемиями IIa, IIb и III типов. Препараты этого класса позволяют снизить уровень ХС ЛПНП на 25 – 50 %. Некоторые статины обладают и гипотриглицеридемическим эффектом. Например, применение аторвастатина позволяет снизить уровень ТГ на 25 – 45 %. В клинической практике применяются следующие препараты: ловастатин (мевакор) – 20 – 80 мг/сут, симвастатин (зокор) – 10 – 40 мг/сут, правастатин (липостат) – 20 – 40 мг/сут, флувастатин (лескол) – 20 – 40 мг/сут, аторвастатин (липримар) – 10 – 20 мг/сут, розувастатин (крестор) – 5 – 10 мг/сут. В последние годы все более популярной становится концепция «агрессивной» липидснижающей терапии, в соответствии с которой у пациентов высокого и очень высокого риска для достижения целевых значений ХС ЛПНП применяются высокие дозы статинов: симвастатина и аторвастатина – до 80 мг/сут, розувастатина – до 40 мг/сут. Для снижения уровня ХС ЛПНП на 35 – 40 % от исходного требуется применение симвастатина в дозе 40 мг/сут, аторвастатина – в дозе 20 мг/сут, розувастатина – в дозе 5 – 10 мг/сут, для снижения ХС ЛПНП на 45 – 50 % от исходного доза симвастатина должна составлять 80 мг/сут, доза аторвастатина – 40 мг/сут, доза розувастатина – 20 мг/сут. Статины применяются 1 раз в сутки, вечером, после еды. Статины являются довольно безопасными лекарственными препаратами. Изредка прием статинов может сопровождаться болями в животе, метеоризмом, запорами. У 1 – 3 % больных наблюдается повышение активности печеночных ферментов. Прекращение приема статинов считается оправданным, если на фоне лечения уровень аланиновой или аспарагиновой аминотрансферазы при двух последовательных измерениях более чем в 3 раза превысит верхнюю границу нормальных значений. Менее чем в 1 % случаев лечения статинами возникают миалгия и миопатия. Выраженная миопатия проявляется болями в мышцах, мышечной слабостью и повышением активности креатинфосфокиназы, в 5 раз превышающим верхнюю границу нормы. Если своевременно не диагностировать миопатию и не прекратить прием статинов, возможно развитие рабдомиолиза – редкого и тяжелого осложнения лекарственной терапии.
Эзетимиб ингибирует абсорбцию ХС, что вызывает уменьшение его содержания в гепатоцитах, а вследствие этого – усиление экспрессии рецепторов ЛПНП и увеличение захвата ХС ЛПНП из плазмы крови. Препарат не влияет на всасывание жирных кислот, ТГ и жирорастворимых витаминов. Эзетимиб рекомендуется к применению в комбинации со статинами при их недостаточной эффективности в среднетерапевтических дозах. Возможно применение этого препарата и в режиме монотерапии при индивидуальной непереносимости статинов. Эзетимиб назначается в дозе 10 мг один раз в день независимо от приема пищи.
Секвестранты желчных кислот – это сложные полимерные соединения, которые в просвете тонкого кишечника связывают желчные кислоты, что препятствует их обратному всасыванию. В результате активизируется синтез желчных кислот в печени и возрастает потребность в необходимом для этого процесса ХС. В гепатоцитах усиливается экспрессия рецепторов ЛПНП, за счет чего увеличивается поступление ХС из крови в печеночные клетки. На фоне лечения секвестрантами желчных кислот уровень ХС ЛПНП снижается на 15 – 30 %. В качестве гиполипидемических средств секвестранты желчных кислот используются более 30 лет. Наиболее известными препаратами этого класса являются холестирамин (8 – 24 г/сут) и холестипол (5 – 30 г/сут). Лечение этими препаратами довольно часто вызывает запоры и диспептические расстройства. К числу побочных эффектов секвестрантов желчных кислот относится гипертриглицеридемия. В связи с этим они противопоказаны при гиперлипидемиях III и IV типов. Кроме того, секвестранты желчных кислот затрудняют всасывание других лекарственных средств и жирорастворимых витаминов, поэтому их следует принимать за 1 – 2 ч до либо через 4 ч после приема других препаратов.
Фибраты активируют печеночную липопротеидлипазу, ингибируют ферменты, участвующие в синтезе жирных кислот, усиливают выведение ХС с желчью. За счет влияния на метаболизм ЛПОНП фибраты значительно, на 30 – 50 % снижают уровень ТГ. Кроме того, препараты этого класса вызывают снижение уровня ХС ЛПНП на 10 – 15 % и повышение уровня ХС ЛПВП на 10 – 20 %. Основным показанием к применению фибратов является гиперлипопротеидемия IV типа в сочетании с низким уровнем ХС ЛПВП. В случаях комбинированной гиперлипопротеидемии (типы IIb и III) возможна комбинация фибратов со статинами. Дозы и частота приема основных препаратов этой группы составляют: ципрофибрат (липанор) – 100 мг 1 – 2 раза в сутки, безафибрат (холестенорм) – 200 мг 2 – 3 раза в сутки, фенофибрат (липантил 200 М и трайкор 145 мг) – соответственно 200 мг и 145 мг 1 раз в сутки. Побочные эффекты фибратов наблюдаются у 5 – 10 % больных. Наиболее частыми из них являются тошнота, боли в животе, запоры, диарея, метеоризм. В некоторых случаях возникают головные боли и бессонница. При сочетании фибратов со статинами возрастает риск развития миопатии. Применение фибратов первого поколения ассоциировалось с повышенным риском желчекаменной болезни. Современным препаратам это побочное действие не свойственно.
Никотиновая кислота оказывает гиполипидемическое действие за счет торможения синтеза ЛПОНП в связи с уменьшением поступления жирных кислот из жировой ткани. Этот эффект проявляется при применении никотиновой кислоты в дозе 2 – 4 г/сут. На фоне лечения никотиновой кислотой отмечается снижение уровня ХС ЛПНП на 10 – 20 %, снижение уровня ТГ на 20 – 30 % и повышение уровня ХС ЛПВП на 15 – 20 %. Основное показание к применению никотиновой кислоты – гиперлипопротеидемия IIb типа, а также гипертриглицеридемия в сочетании с низким уровнем ХС ЛПВП. Никотиновую кислоту целесообразно назначать больным, у которых перечисленные типы гиперлипидемий сочетаются с облитерирующим атеросклерозом сосудов нижних конечностей, так как это соединение обладает сильным сосудорасширяющим действием. Пролонгированная форма никотиновой кислоты – препарат эндурацин – назначается в дозе 0,5 г 3 раза в день. Побочные явления: гиперемия лица и верхней половины туловища, ощущение жара, тахикардия, кожный зуд. Эти явления можно ослабить, увеличивая дозу никотиновой кислоты постепенно и назначая за 30 мин до ее приема аспирин в дозе 0,125 г. Принимать никотиновую кислоту рекомендуется во время приема пищи.
Омега-3-полиненасыщенные жирные кислоты оказывают комбинированное антиатерогенное действие за счет усиления фибринолитической активности плазмы, антивоспалительного действия, восстановления функции эндотелия, улучшения функционального состояния клеточных мембран, снижения уровня триглицеридов в плазме крови. Препараты этого класса рекомендуются для лечения больных с гиперлипидемиями IV и V типов. Применение омега-3-полиненасыщенных жирных кислот позволяет улучшить прогноз больных, перенесших ИМ, за счет снижения риска общей, сердечно-сосудистой и внезапной смерти. Этот эффект связывают с их стабилизирующим воздействием на мембраны кардиомиоцитов. В России зарегистрирован один лекарственный препарат, содержащий высокоочищенные омега-3-полиненасыщенные жирные кислоты – омакор. Одна капсула препарата содержит около 0,9 г омега-3-полиненасыщенных жирных кислот. Для коррекции гипертриглицеридемии рекомендуется принимать 2 – 4 капсулы омакора в сутки.
В некоторых случаях, обычно у больных семейными дислипопротеидемиями, при значительном повышении уровней ХС и атерогенных липопротеидов с целью коррекции липидного спектра крови применяется процедура плазмафереза. Селективный плазмаферез позволяет с помощью иммунных и химических сорбентов избирательно удалять из крови ЛПНП. Регулярные процедуры плазмафереза в сочетании с медикаментозной терапией обеспечивают стабильный гиполипидемический эффект и торможение прогрессирования атеросклероза.
1.3. ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ
Определение. Термином «артериальная гипертензия» обозначают синдром повышения АД. Диагностическим критерием АГ является повышение систолического АД до 140 и более мм рт. ст. и/или повышение диастолического АД до 90 и более мм рт. ст.
Гипертоническая болезнь (ГБ) – это хроническое заболевание, основным проявлением которого является синдром АГ, не связанный с наличием патологических процессов, при которых повышение АД обусловлено известными причинами (симптоматические или вторичные АГ). Термин «гипертоническая болезнь» был предложен Г. Ф. Лангом и является синонимом употребляемого в других странах термина «эссенциальная артериальная гипертензия».
Распространенность. Повышенное АД регистрируется в среднем у 25 % взрослых. Частота АГ прогрессивно увеличивается с возрастом: в популяции до 39 лет распространенность АГ составляет 10 – 15 %, в популяции старше 60 лет – более 50 %. У лиц пожилого и старческого возраста несколько реже, чем у людей молодого и среднего возраста, отмечается изолированная диастолическая АГ, но значительно чаще встречается изолированная систолическая АГ.
В Российской Федерации распространенность АГ составляет 39,2 % среди мужчин и 41,1 % среди женщин. Знают о наличии АГ 37,1 % мужчин и 58,9 % женщин. Принимают антигипертензивные лекарственные средства 21,6 % мужчин и 45,7 % женщин, но лечатся эффективно (т. е. достигают нормального уровня АД) всего лишь 5,7 % мужчин и 17,5 % женщин.
АГ является важнейшим фактором риска сердечно-сосудистых заболеваний. Популяционные исследования показали, что у больных ГБ по сравнению с лицами, имеющими нормальное АД, значительно возрастает вероятность развития инсульта, ИБС и хронической сердечной недостаточности. В связи с этим снижение смертности от сердечно-сосудистых заболеваний в немалой степени определяется эффективностью лечения ГБ.
Этиология. Согласно современным представлениям, главным фактором риска развития ГБ является наследственная отягощенность по этому заболеванию. К настоящему времени выявлены многочисленные гены, дефекты которых предрасполагают к АГ. К их числу относятся гены ангиотензинпревращающего фермента (АПФ), ангиотензиногена, ренина, гены, определяющие объем внеклеточной жидкости, реакцию на солевую нагрузку и реабсорбцию натрия, чувствительность тканей к инсулину, проницаемость клеточных мембран, функцию ионных каналов и др. Развитию ГБ способствуют и другие факторы: возраст, избыточная масса тела, потребление поваренной соли в количестве, превышающем физиологическую норму, недостаточное содержание в пище калия, кальция и магния, гиподинамия, курение, злоупотребление алкоголем. Наиболее сильным экзогенным фактором риска ГБ является психоэмоциональный стресс. Важное значение нервно-психического перенапряжения, возникающего после острых и длительных эмоциональных перегрузок, в стабилизации АГ подчеркивалось в классических трудах Г. Ф. Ланга и А. Л. Мясникова. Позднее была обнаружена связь риска развития этого заболевания с особенностями личности. Для пациентов с высоким риском стабилизации АГ характерны скрытая агрессивность, амбициозность, стремление к лидерству, эмоциональная лабильность, торопливость и импульсивность. Эти качества нередко сочетаются с ощущением постоянной тревоги и периодами депрессии.
Развитие ГБ зависит от взаимодействия генетических и средовых факторов. Механизмы этого взаимодействия остаются в полной мере невыясненными. Однако есть основания полагать, что причинно-следственные связи между двумя указанными группами факторов имеют двунаправленный характер: с одной стороны, генетические особенности определяют реакцию организма на факторы внешней среды, а с другой стороны, экзогенные воздействия способствуют проявлению генетических дефектов.
Патогенез. Основными физиологическими параметрами, определяющими уровень АД, являются ударный объем крови, объем циркулирующей крови, эластичность стенок аорты и ее крупных ветвей, сопротивление кровотоку на уровне мелких артерий и артериол, вязкость крови. Ведущую роль в формировании АД играют два гемодинамических показателя: минутный объем кровообращения, представляющий собой произведение ударного объема крови на ЧСС, и общее периферическое сосудистое сопротивление. В условиях нормальной нейрогуморальной регуляции кровообращения объем крови, нагнетаемый сердцем в сосуды, и сосудистый тонус взаимозависимы – изменение одного из этих параметров ведет к противонаправленным изменениям другого. Благодаря сбалансированности минутного объема кровообращения и общего периферического сосудистого сопротивления поддерживается оптимальный для организма уровень АД и предотвращаются его резкие колебания. Нарушение регуляции производительности сердца и сосудистого тонуса, а также их взаимного влияния ведет к неадекватным изменениям АД.
Выделяют следующие варианты изменений центральной гемодинамики, обусловливающие стойкое повышение АД:
1) увеличение минутного объема кровообращения при отсутствии адекватного снижения сосудистого сопротивления;
2) повышение сосудистого сопротивления при отсутствии адекватного уменьшения минутного объема кровообращения;
3) сочетанное повышение минутного объема кровообращения и сосудистого сопротивления.
Распространенность различных гемодинамических вариантов АГ неодинакова. Более чем в 80 % случаев у больных ГБ отмечается повышение общего периферического сосудистого сопротивления.
Согласно нейрогенной концепции патогенеза ГБ, разработанной Г. Ф. Лангом и А. Л. Мясниковым, в основе данного заболевания лежит нарушение регуляции кровообращения, возникающее вследствие перенапряжения и травматизации психической сферы человека. Важную роль в становлении АГ играет активация симпатико-адреналовой системы. На начальном этапе заболевания у многих больных отмечается гиперкатехоламинемия, что проявляется увеличением частоты сердечных сокращений и сократимости миокарда с формированием гипердинамического типа гемодинамики и повышением сосудистого тонуса. Кроме того, симпатикотония сопровождается усилением синтеза других нейрогормонов, способствующих повышению АД за счет влияния на тонус артерий, реабсорбцию натрия и воды (ренин, ангиотензин II, альдостерон, вазопрессин). Активация симпатико-адреналовой системы представляет собой механизм, посредством которого реализуются гемодинамические эффекты психоэмоционального напряжения, что объединяет данную концепцию с нейрогенной концепцией патогенеза ГБ. Вместе с тем существуют и другие причины гиперсимпатикотонии: изменение чувствительности барорецепторов и адренорецепторов, нарушение обратного захвата норадреналина в синаптической щели, снижение тонуса парасимпатической нервной системы.
Развитие АГ может быть связано с расстройством механизмов регуляции водно-солевого обмена, вследствие которого происходит задержка натрия и развивается гиперволемия. Нефросклероз (в том числе и развивающийся на поздних этапах ГБ) является не единственной причиной нарушения экскреторной функции почек. Задержка натрия и воды в организме может быть обусловлена активацией симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем, а также снижением активности системы натрийуретических пептидов. Согласно концепции А. Гайтона, снижение способности почек экскретировать натрий, которое отмечается у ряда больных на раннем этапе заболевания, является не следствием, а причиной АГ. Повышение АД в таких случаях представляет собой компенсаторную реакцию, обеспечивающую усиление натрийуреза и тем самым направленную на поддержание нормального водно-электролитного баланса.
«Мембранная» теория патогенеза АГ, предложенная Ю. В. Постновым и С. Н. Орловым, объясняет повышение АД генетически обусловленным дефектом плазматических мембран, вследствие которого нарушается трансмембранный транспорт ионов кальция. Накопление кальция в цитозоле вызывает повышение тонуса гладкомышечных клеток сосудистой стенки и усиление сократимости кардиомиоцитов, а также способствует активации симпатико-адреналовой системы и сопровождается повышением чувствительности клеток к прессорному действию норадреналина.
В соответствии с современными представлениями, на ранних этапах развития ГБ ведущую роль в повышении АД играет нейрогуморальный дисбаланс, важнейшим проявлением которого является нарушение функционирования ренин-ангиотензин-альдостероновой системы. Основной эффекторный пептид этой нейрогуморальной системы – ангиотензин II – не только циркулирует в кровотоке, но и образуется в тканях. Циркулирующий ангиотензин II вызывает кратковременные эффекты: увеличение частоты сердечных сокращений, вазоконстрикцию, задержку натрия и воды. Тканевой ангиотензин II обусловливает долговременные эффекты активации ренин-ангиотензин-альдостероновой системы, к которым относятся гипертрофия миокарда, формирование и прогрессирование кардиосклероза, гипертрофия гладкомышечных клеток сосудистой стенки, снижение эластичности и стойкое сужение просвета мелких артерий, повышение давления в почечных клубочках с их последующей гибелью и развитием нефросклероза. Активация ренин-ангиотензин-альдостероновой системы способствует развитию дисфункции эндотелия, которая проявляется нарушением баланса секретируемых эндотелиальными клетками биологически активных веществ: продукция оксида азота, фактора гиперполяризации эндотелия и простациклина, обладающих вазодилататорным, антипролиферативным и антиагрегантным свойствами, уменьшается, а выработка эндотелинов, тромбоксана А2 и других соединений, вызывающих вазоконстрикцию, пролиферацию гладкомышечных клеток и агрегацию тромбоцитов, возрастает.
В «метаболической» теории формирования АГ центральная роль отводится инсулинорезистентности тканей. Снижение чувствительности тканей к инсулину обусловлено мутацией генов и воздействием средовых факторов. В большинстве случаев инсулинорезистентность сочетается с ожирением и сопровождается дисфункцией эндотелия, повышением содержания натрия и кальция в гладкомышечных клетках сосудистой стенки, что способствует их пролиферации и повышению чувствительности мелких артерий к вазоконстрикторным влияниям. Следствием инсулинорезистентности является гиперинсулинемия, которая в свою очередь приводит к повышению активности симпатико-адреналовой системы, гипертрофии гладкой мускулатуры сосудов, усилению реабсорбции натрия. Помимо изменений, обусловливающих повышение АД, инсулин стимулирует синтез холестерина и процесс окисления липидов в сосудистой стенке, тем самым способствуя прогрессированию атеросклероза.
Таким образом, механизмы формирования АГ разнообразны. Сочетание патогенетических механизмов, их роль в становлении и прогрессировании ГБ определяются индивидуальным набором генетически детерминированных и средовых факторов каждого пациента.
Морфология. АГ сопровождается развитием морфологических изменений в органах-мишенях, основными из которых являются сердце, артериальные сосуды, почки и головной мозг.
Характерным признаком «гипертонического сердца» является увеличение массы миокарда левого желудочка. В миокарде больных ГБ увеличивается не только масса миоцитов, но и содержание экстрацеллюлярного матрикса, развивается гиперплазия фибробластов и возрастает продукция коллагена, т. е. прогрессирует кардиосклероз. Аналогичные изменения происходят и в стенках магистральных артерий, утолщение и фиброз которых сопровождаются прогрессирующим снижением эластичности. Изменения сосудов почек в сочетании с характерным для АГ нарушением ауторегуляции почечного кровотока приводят к развитию нефросклероза, вплоть до формирования первично сморщенной почки. Поражение сосудов сетчатки при тяжелой АГ проявляется образованием микроаневризм, тромбозами, кровоизлияниями, отеком соска зрительного нерва. Повышенное АД вызывает развитие гипертрофии и липогиалиноза стенки мелких внутримозговых артерий. Вследствие сужения их просвета ухудшается перфузия и происходит разрежение белого вещества головного мозга. Окклюзия мелких внутримозговых артерий приводит к возникновению лакунарных инфарктов, а разрывы микроаневризм – к кровоизлияниям в ткань мозга с последующим формированием кист.
Поскольку АГ ускоряет развитие атеросклероза крупных артерий, соответствующие изменения сосудистой стенки аорты, артерий нижних конечностей, коронарных, мозговых артерий, а также гистологические признаки перенесенных ИМ и ишемических инсультов могут рассматриваться как косвенные морфологические проявления ГБ.
Классификация. Принятая в России и европейских странах классификация величины АД у лиц старше 18 лет представлена в табл. 1.6. Если значения систолического АД и диастолического АД попадают в разные категории, то степень тяжести АГ оценивается по более высокой категории. Наиболее точно степень АГ может быть определена у пациентов с впервые диагностированной АГ и у больных, не принимающих антигипертензивные препараты.
Таблица 1.6
Классификация уровней АД, мм рт. ст.

*Изолированная систолическая АГ должна классифицироваться на 1-ю, 2-ю, 3-ю степень согласно уровню систолического АД.
Результаты суточного мониторирования АД и самостоятельных измерений АД пациентом в домашних условиях могут помочь в диагностике АГ, но не заменяют повторные измерения АД медицинским работником. Критерии диагностики АГ по результатам измерений АД, выполненных врачом, пациентом в домашних условиях, и по данным суточного мониторирования АД различны. О наличии АГ свидетельствуют уровни АД 8 140/90 мм рт. ст. при измерении медицинским работником, 8135/85 мм рт. ст. при измерении пациентом в домашних условиях и среднесуточное АД 8 130/80 мм рт. ст. по данным суточного мониторирования.
Тяжесть АГ, прогноз и тактика лечения больного определяются не только уровнем АД. Помимо определения степени АГ оценка общего сердечно-сосудистого риска включает анализ факторов риска, диагностику поражения органов-мишеней и ассоциированных клинических состояний.
К факторам риска, значимо влияющим на прогноз больных АГ, относятся:
1) величина пульсового АД (у пожилых);
2) возраст (мужчины > 55 лет, женщины > 65 лет);
3) курение;
4) дислипидемия: общий ХС > 5,0 ммоль/л (190 мг/дл), или ХС ЛПНП > > 3,0 ммоль/л (115 мг/дл), или ХС ЛПВП < 1,0 ммоль/л (40 мг/дл) для мужчин и <1,2 ммоль/л (46 мг/дл) для женщин, или ТГ > 1,7 ммоль/л (150 мг/дл);
5) глюкоза плазмы натощак 5,6 – 6,9 ммоль/л (102 – 125 мг/дл);
6) нарушение толерантности к глюкозе;
7) семейный анамнез ранних сердечно-сосудистых заболеваний (у мужчин < < 55 лет, у женщин < 65 лет);
8) абдоминальное ожирение (окружность талии > 102 см для мужчин и > > 88 см для женщин) при отсутствии метаболического синдрома.
О поражении органов-мишеней свидетельствуют признаки гипертрофии левого желудочка, утолщения и снижения эластичности стенок крупных артерий, нарушения функции почек.
К признакам гипертрофии левого желудочка относятся:
1) ЭКГ-критерии: признак Соколова – Лайона (сумма глубины зубца S вотведении V1 и высоты зубца R в отведении V5 или V6) > 38 мм, корнельское произведение (сумма высоты зубца R в отведении aVL и глубины зубца S в отведении V3, умноженная на продолжительность комплекса QRS) > 2440 мм/мс;