
Клеточные и молекулярные механизмы патогенеза иммуновоспалительных ревматических заболеваний
Продукция Tfh-клетками хемокина CXCL13 и его взаимодействие с хемокиновым рецептором CXCR5 на В-лимфоцитах способствует формированию агрегатов В-лимфоцитов, которые являются важной составляющей ELS. Выраженная экспрессия CXCR5 на В-лимфоцитах в составе воспалительного инфильтрата определяется при ревматоидных синовитах. Это взаимодействие стимулирует В-лимфоциты к трансформации в плазматические клетки, продуцирующие ауто-АТ локально, в очаге продуктивного воспаления, в условиях ELS [30].
На рис. 5 представлены лимфоплазмоцитарные инфильтраты при ревматоидном синовите, принимающие формы фолликулоподобных структур и иммуногистохимическую идентификацию хемокина CXCL13 в этих структурах в синовиальной оболочке при РА в крайнем справа фото.

Рис. 5. Слева (А, В) видны лимфоплазмоцитарные инфильтраты при ревматоидном синовите, принимающие формы фолликулоподобныхструктур (Х 100), по материалам [160] Крайний справа снимок отражает иммуногистохимическую идентификацию хемокина CXCL13 (указано стрелками) в фолликулоподобной структуре в синовиальной оболочке при РА (Х 100), по материалам [68]
Фолликулоподобные структуры включают в себя макрофаги (CD68+), Т-лимфоциты (CD4+), В-лимфоциты (CD20+), дендритные клетки (CD303+). При РА в них определяются большие клеточные агрегаты, включающие скопления фДК, обладающих высокой АГ-презентирующей способностью [122].
На рис. 6 представлены фото фолликулоподобных структур в синовиальной оболочке при РА. Видно, что эктопические герминативные центры находятся на разных стадиях своего формирования и функционального состояния. Наличие очагов эктопического лимфоидного неогенеза с герминативными центрами позволяют выделить определённые патофизиологические варианты РА [31].

Рис. 6. Видны множественные эктопические герминативные центры (фолликулоподобные структуры) в синовиальной оболочке при РА на разных стадиях своего развития (Х 100), по материалам [78]
Кроме этого, со стадией развития указанных структур (начальные этапы, затем этапы с формированием герминативных центров) хорошо коррелируют с наличием сывороточного ревматоидного фактора (РФ), ревматоидных узелков и, особенно, с тяжестью эрозий суставного хряща. Лимфоидный неогенез при РА определялся в биопсийном материале в 31 % случаев [160]. У пациентов с серопозитивным РА могут организовываться агрегаты Т-клеток в синовиальной ткани. Это часто мелкие или средние агрегаты, хотя у – 10–15 % пациентов развиваются более организованные агрегаты, имеющие черты сходства с герминативными центрами (GC) [100, 121].
Имеются данные, согласно которым значительная роль в эктопическом лимфоидном неогенезе принадлежит цитокинам семейства ТНФ, хемокинам CXCL13 и CCL21, адгезионным молекулам MAdCAM [68].
Как указывалось выше, принципиально единообразные патоморфологические изменения при системной прогрессирующей дезорганизации рыхлой волокнистой соединительной ткани свойственны всем нозологическим формам ИВРС. Это же касается и лимфоидного неогенеза. В качестве иллюстрации сказанного приводим рис. 7, где представлены фолликулоподобная структура в синовиальной оболочке при РА слева и фолликулоподобная структура в дерме и в мышечной ткани при СКВ. Видно, что морфологическая организация этих структур при РА и СКВ имеет черты определённого сходства. Важен тот факт, что процент мононуклеаров и нейтрофилов, подвергшихся апоптозу и находящихся в фолликулоподобных структурах при СКВ статистически значимо превышал аналогичные показатели в контрольной группе и коррелировал со степенью тяжести клинического течения СКВ [24].

Рис. 7. Слева фолликулоподобная структура с центром размножения (стрелка) в синовиальной оболочке при РА (Х 50), по материалам [173]. Справа фолликулоподобные структуры в дерме и в мышечной ткани при системной красной волчанке, Х100, по материалам [24]
Лимфоидный неогенез свойственен и для других иммуновоспалительных заболеваний – тиреоидита Хашимото, миастения гравис, Helicobacter pylori – индуцированного гастрита [68].
На рис. 8 представлена картина фолликулоподобной структуры в щитовидной железе при тиреоидите Хашимото слева и аналогичной структуры при дерматомиозите справа. И в этом случае прослеживается структурная аналогия.

Рис. 8. Слева фолликулоподобная структура в щитовидной железе при тиреоидите Хашимото, по материалам [82]. Справа аналогичная структура при дерматомиозите (Х100), по материалам [5]
Эктопический лимфоидный неогенез документирован при синдроме Шегрена, рис. 9.
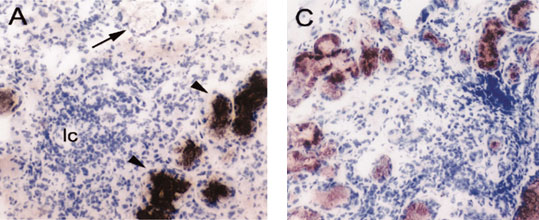
Рис. 9. Лимфоплазмоцитарные инфильтраты в слюнной железе при синдроме Шегрена. Видно, что эти инфильтраты принимают формы фолликулоподобных лимфоидных структур (Х100), по материалам [132]
Видно, что лимфоплазмоцитарные инфильтраты в слюнной железе при синдроме Шегрена. принимают формы фолликулоподобных лимфоидных структур. При этом в лимфоплазмоцитарных инфильтратах большинство клеток составляли CD4+αβ Т-лимфоциты и только 5–15 % клеточного инфильтрата относились к В-лимфоцитам, плазматическим клеткам и CD8+лимфоцитам. Также как и при РА, при синдроме Шегрена в КВИ интенсивно эксрессируется хемокин CXCL13, обладающий выраженными свойствами привлекать в очаг провоспалительные клетки. В местах компактного скопления В-лимфоцитов в виде очаговых инфильтратов в слюнных железах при синдроме Шегрена была определена продукция анти-Ro/SSA и анти-La/SSB аутоантител [28, 159].
К числу причин скопления лимфоцитов в очаге воспаления с последующим формированием фолликулоподобных структур при синдроме Щегрена относят и экспрессию аллелей (HLA)-DR, B7.1 и B7.2 на эпителии воспалённых слюнных желёз. В лимфоплазмоцитарных инфильтратах Т- и В-лимфоциты располагались в отдельных зонах, напоминающих Т-зависимые и В-зависимые зоны во вторичных лимфоидных органах. Присутствие в подобных лимфоплазмоцитарных инфильтратах, напоминающих зародышевые центры, признаков АГ-специфической клональной пролиферации В-лимфоцитов и плазматических клеток подтверждает гипотезу эктопического лимфоидного неогенеза и продукции ауто-АТ [149]. Кроме этого, в этих же локусах определялись посткапиллярные венулы, выстланные высоким эндотелием, где происходит миграция КВИ в очаг воспаления. Для этого процесса необходима продукция белков семейства TNF, а также хемокинов CXCL13 и CCL21, привлекающих к очагу воспаления Т- и В-лимфоциты [69].
В целом, важной особенностью формирования ELS является факт присутствия в них плазматических клеток, продуцирующих ауто-АТ. По литературным данным это определено также при рассеянном склерозе, при СКВ, при отторжении трансплантатов почек и сердца.
Взаимодействия Т-клеток с В-клетками в условиях ELS могут воспроизводить многие ключевые особенности продуктивных взаимодействий в лимфоидных фолликулах вторичных лимфоидных органов. Это касается соматических гипермутаций, переключения синтеза классов иммуноглобулинов и дифференцировки плазматических клеток, что наблюдается, например, в воспаленной синовиальной оболочке при РА в фолликулоподобных структурах или в тубулоинтерстициальных клеточных агрегатах в почках при волчаночном нефрите [38,71,136].
Накопление лимфоцитов и плазматических клеток в хронически воспаленных тканях происходит при многих заболеваниях и для обозначения этих явлений некоторые авторы предлагают термин “лимфоплазматический инфильтрат”, который нередко встречается при описаниях патоморфологии биоптатов.
Таким образом, срыв аутотолерантности и аутоиммунизация при ИВРЗ создают условия для формирования эктопических лимфоидных структур. Структурно-функциональная организация этих структур отражает состояние гиперреактивности иммунной системы, эффекторная фаза которой связана с образованием ауто-АТ и ауто-реактивных Т-лимфоцитов.
1.3. ГЗТ-гранулёмы
По определению “гранулёма – это компактная (организованная) совокупность зрелых, активированных мононуклеарных фагоцитов и лимфоцитов, которая необязательно сопровождается дополнительными признаками, такими как некроз” и далее “гранулёма отличается от хронического воспалительного инфильтрата характерной организацией зрелых макрофагов в компактную структуру”. Макрофаги приобретают вид “эпителиоидных” клеток, которые в силу невыясненных причин могут организовываться в гигантские, многоядерные клетки по типу гигантских клеток Лангханса. Можно сказать, что гранулёмы при ИВРЗ являются выражением иммунологической активности КВИ [63,116].
Несмотря на то, что история изучения гранулём и гранулематозного воспаления насчитывает более 150 лет, патофизиологический и иммунологический смысл этой структуры осознан не до конца. Считается, что, в целом, предназначение гранулём – это защита от внутриклеточных патогенов и отграничение очага гранулематозного воспаления. Однако идентифицировать этиологически важный патогенный агент в ревматических гранулёмах не удаётся. Гранулёмы при ИВРЗ относят к клеточной гиперергической реакции врождённого и адаптивного иммунитета, вбирающие в себя признаки продуктивного воспаления in situ. Гранулёмы, или узелки, сравнивают с обоюдоострым мечом, влияющим как на элиминацию этиологического агента, так и на тканевую деструкцию [168].
Кандидатными триггерами ревматических гранулём и аутоиммунного ответа могут быть продукты дезорганизации соединительной ткани, в частности, очаги фибриноидного некроза. На рис. 10 представлена патоморфологическая картина ревматоидного узелка при ревматоидном артрите (слева), а также гранулёмы в миокарде при ревматической лихорадке. Видно, что мононуклеарные клетки, прежде всего, клетки макрофагально-моноцитарного ряда и лимфоциты в составе КВИ, четко располагаются вокруг очагов фибриноидного некроза.
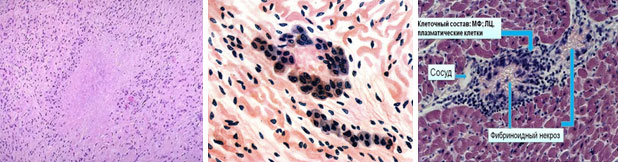
Рис. 10. Слева ревматоидный узелок (Х100). Справа два снимка гранулёмы в миокарде при ревматической лихорадке. В центре гранулём продукты распада основного вещества соединительной ткани, вокруг мононуклеарная инфильтрация (Х200), по материалам [14]
Характерной чертой формирования гранулематозного воспаления при ИВРЗ является присутствие признаков гиперергического клеточного иммунного ответа, или, иными словами, гиперчувствительности замедленного типа (ГЗТ), в которой центральная роль принадлежит клеткам макрофагально-моноцитарного ряда. К признакам ГЗТ при гранулематозном воспалении при ИВРС относят активированное состояние клеток в составе гранулём, их компактное расположение, обеспечивающие межклеточные контакты, прежде всего, макрофагально-лимфоцитарные, трансформация макрофагов в эпителиоидные клетки, продукция широкого спектра провоспалительных цитокинов, провоспалительных хемокинов, ростовых факторов, факторов ангиогенеза, интерферонов. Именно поэтому этот тип гранулём носит название ГЗТ-гранулём.
Этапность формирования ГЗТ-гранулём и клеточный состав определяет спектр провоспалительных хемокинов, источниками которых являются активированные клетки макрофагально-моноцитарного ряда, Т-лимфоциты, эндотелиоциты. В составе гранулём находят макрофаги (CD68+), моноциты (CD14+), Т-лимфоциты (включая CD4+Th1, CD4+Th17, CD8+), плазмацитоидные и миелоидные дендритные клетки (CD205+), В-лимфоциты, естественные киллеры (CD56+), нейтрофилы, эозинофилы [114,116]. Находящиеся в очаге гранулематозного воспаления антиген-специфические CD4+клетки дифференцируются в Th1 CD4+субпопуляцию – эффекторов ГЗТ, с последующей продукцией провоспалительных цитокинов IL-1α, IL-1β, IL-6, IL-4, IL-12, TNF-α, IFN-γ, провоспалительных хемокинов – IL-8, СС-хемокинов, хемоаттрактантного моноцитарного белка 1 (МСР-1), макрофагального воспалительного протеина 1α (MIP-1α), иммунорегуляторных цитокинов – IL-10, IL-12, а также матриксных металлопротеиназ (ММР1–9), витронектина, остеопорина, фибронектина. В продукции указанных растворимых факторов активное участие принимают Мф, ДК и гигантские клетки [102,103].
Подобный широкий хемо-цитокиновый спектр обеспечивает дополнительное привлечение провоспалительных клеток in situ. Стимулом для дифференцировки CD4+клеток в направлении Th1 является продукция клетками макрофагально-моноцитарного ряда IL-12 и IL-18, а также продукция естественными киллерами IFN-γ [74,84].
Подчеркнём важное качество ГЗТ-гранулём. Речь идёт о том, что описанная выше последовательность дезорганизации соединительной ткани сопровождается сопряжённой клеточной реакцией и на этапе фибриноидных измненений и фибриноидного некроза эта клеточная реакция может приобретать вид ГЗТ-гранулём. Участки дезорганизации соединительной ткани одновременно служат источником ауто-АГ. Заметно усиливаются АГ-зависимые контакты Мф с лимфоцитами. Наиболее ярко эти процессы представлены в гранулёмах Ашофа-Талалаева при ревматической лихорадке. Тот факт, что клетки макрофагально-моноцитарного ряда, в типичном выражении, веерообразно располагаются вокруг центрального участка фибриноидного некроза, подчёркивает возможность контакта АПК с продуктами дезорганизации соединительной ткани с потенциально ауто-АГ свойствами.
Сказанное иллюстрируется картиной гранулёмы Ашоффа-Талалаева при ревматическом миокардите, представленной на рис. 11, где определяются крупные гиперхромные (активированные) макрофаги, а также лимфоциты, располагающиеся вокруг и в очагах фибриноидного некроза.

Рис. 11. Гранулёма Ашоффа-Талалаева при ревматическом миокардите. Видны крупные гиперхромные макрофаги, лимфоциты, очаги фибриноидного некроза (Х200), по материалам [14]
На Мф и ДК в очагах иммунного гранулематозного воспаления существенно возрастает экспрессия аллелей локусов МНС II класса – HLA-DR, HLA-DQ, HLA-DP, а также маркера CD205, Одновременное присутствие пролиферирующих Т-лимфоцитов формирует возможность индукции аутоиммунного ответа in situ. В качестве иллюстрации сказанного приводим снимки препаратов иммунных гранулём при болезни Крона. На рис. 12 видны четкая компактная локализация CD205+ клеток в центре иммунных гранулём. CD205 – это мембранный маркёр, экспрессирующийся на активированных Мф и ДК. В этих же местах также четко визуализируются интрагранулематозные CD3+лимфоциты (зелёный цвет) в тесном контакте с CD205+ клетками (красный цвет). Причём CD3+лимфоциты являются пролиферирующими, что документируется по экспрессии маркёра клеточной пролиферации Ki67 [114].
Очевидно, что микроокружение в иммунных гранулёмах, межклеточные контакты создают благоприятные условия для аутоиммунного ответа in situ.
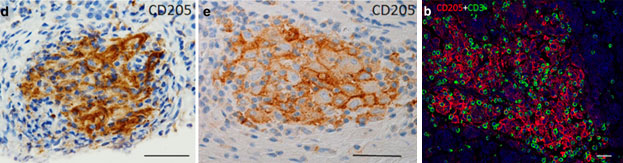
Рис. 12. Иммунные гранулёмы при болезни Крона. Иммуногистохимическая идентификация CD205+ клеток (d,e); CD3+лимфоциты (зелёный цвет) и CD205+макрофаги и дендритные клетки (красный цвет) в иммунной гранулёме, метод иммунофлуоресценции (b), по материалам [114]
Гранулёмы при ИВРЗ морфологически относят к эпителиоидным гранулёмам. Формирование таких компактных мононуклеарных инфильтратов обусловлено деятельностью активированных резидентных макрофагов и эмиграцией в очаг воспаления из посткапиллярных венул, выстланных “высокими“ эндотелиоцитами 2 типа, моноцитов, лимфоцитов, нейтрофилов [141].
Гранулёмы являются мобильной структурой, отражающей стадию воспаления и, в определённой степени, её нозологическую специфичность. Пул резидентных (тканевых) макрофагов на несколько порядков превышает их костномозговой резерв [6]. Формирование ГЗТ-гранулём является преимущественно местным процессом. Моноциты, Т- и В-лимфоциты гематогенного происхождения дополняют клеточный состав этих гранулём. Активация клеток макрофагально-моноцитарного гистогенеза в составе ГЗТ-гранулём – есть в т. ч. и повышение фагоцитарной активности этих клеток в отношении продуктов дезорганизации соединительной ткани с последующей возможностью выполнения АГ-презентирующей функции и индукцией аутоиммунного ответа.
Можно проследить и некоторую общность структурно-функциональной организации между упомянутыми выше фолликулоподобными (эктопическими) лимфоидными структурами (ELS) и ГЗТ-гранулёмами. Эта общность касается прежде всего, во-первых, идентичности клеточного состава, во-вторых, важной роли макрофагов и их производных в формировании этих патоморфологических структур, в-третьих, спектр продуцируемых провоспалительных цито- и хемокинов практически полностью совпадает, в-четвёртых, микроокружение и в том, и в другом случаях создаёт возможность индукции извращённого аутоиммунного ответа на собственные АГ-детерминанты. Если сравнить картину гранулёмы в миокарде при ревматической лихорадке, представленную слева на рис. 11 с картиной фолликулоподобной структуры в синовиальной оболочке при РА, представленной на рис. 6 и на рис. 7 слева, то очевидное сходство этих структур не вызывает сомнений. В процессах формирования ГЗТ-гранулём и прогрессировании воспалительного процесса также очевидно значение ангиогенеза in situ. В частности, показано, что пролиферация эндотелия капилляров совпадает во времени с пиком мононуклеарной инфильтрации при гранулематозном воспалении [144].
1.4. Адгезионные лиганд-рецепторные взаимодействия и эндотелиальная реакция при хроническом продуктивном воспалении
“Точкой отсчёта” формирования КВИ является сосудисто-эндотелиальная реакция в ответ на действие любого триггера, результатом которой является ангиогенгез. Ангиогенез – это биологический процесс, посредством которого образуются кровеносные сосуды. Этот процесс сопровождается развитием адгезионных межклеточных и клеточно-матриксных взаимодействий, продукцией и рецепцией цито- и хемокинов, эмиграцией клеток из кровотока и активацией резидентных клеток различного гистогенеза и функционального предназначения in situ. Очевидна тесная взаимосвязь и разнонаправленная взаиморегулируемость этих процессов, наиболее демонстративно представленная в виде провоспалительных, аддитивных, синегрических и ингибирующих эффектов цито- и хемокинов. В этих условиях создается микроокружение, благоприятствующее индукции процессов иммуногенеза.
В инициации КВИ значительная роль принадлежит активности эндотелиоцитов. Диапедез лимфоцитов, моноцитов, нейтрофилов, эозинофилов в очаг воспаления происходит преимущественно в области посткапиллярных венул, выстланных “высокими“ эндотелиоцитами 2 типа. Трансформации эндотелиоцитов в “высокий” эндотелий, в частности, способствуют продуцируемые активированными Т-лимфоцитами цитокины (IL-1α, IFN-γ, TNF-α и др.). Активированные эндотелиоциты экспрессируют спектр адгезионных молекул с различным функциональными свойствами. Лиганд-рецепторные взаимодействия между активированными эндотелиоцитами и клетками крови включают в себя десятки молекул, формируя по аналогии с иммунологическим синапсом – синапс эндотелиально-клеточный.
На активированных эндотелиоцитах экспрессируется следующий спектр адгезионных молекул, обепечивающих диапедез клеток крови в очаг воспаления, начиная с этапа прилипания и роллинга и заканчивая выходом клетки из сосудистого русла: селектины – Р-селектин (CD62P) и Е-селектин (CD62E); из иммуноглобулинового семейства – молекулы VCAM и их разновидности [VCAM-1(CD106), ELAM-1, ICAM-1(CD54), ICAM-2]; CD34 для рецепторов миелоидных клеток; муцин GlyCAM-1.
Рецепторами рециркуляции, или хоминг-рецепторами, на лимфоцитах для указанных молекул являются VLA-4 (CD49dCD29), LFA-1 (CD11a CD18), CD44. Кроме этого на лейкоцитах конститутивно экспрессированы L-селектины, рецепторы для Р- и Е-селектинов (PSGL-1). Основной интегрин лимфоцитов LFA-1, представлен и на поверхности моноцитов и макрофагов. Интегрин Мас-1 экспрессируется на Мф, а также на других миелоидных и NK-клетках. Третий интегрин этой группы – p150/р95 – маркер ДК, но он также представлен на других клетках миелоидного ряда. β1-интегрины (молекулы группы VLA) взаимодействуют с компонентами межклеточного матрикса (фибронектином, ламинином, коллагеном, фибриногеном) и мембранным рецептором VCAM-1 (CD106).
На активированном эндотелии экспрессируются:
VLA-1 (CD49a/CD29), его лиганды – коллаген I–V типов;
VLA-3 (CD49b/CD29), его лиганды – фибронектин, коллаген I–V типов, ламинин;
VLA-5 (CD49e/CD29), его лиганды – фибронектин, витронектин;
VLA-6 (CD49f/CD29), его лиганды – ламинин;
LPAM-1 (CD49d/X), его лиганды – фибронектин;
CD51/CD6, его лиганды – витронектин, фибриноген.
Также на активированном эндотелии экспрессируются рецепторы интегринов – ICAM-1 (CD54), ICAM-2 (CD102), VCAM-1 (CD106) [124, 133].
Таким образом, всё многообразие и специфичность адгезионных взаимодействий активированного эндотелия с клетками крови и межклеточным матриксом обеспечивает процесс эмиграции лейкоцитов из кровяного русла в очаг воспаления, что является важным фактором организации КВИ при ревматических заболеваниях.
Не менее важным фактором организации КВИ и межклеточных взаимодействий in situ является экспрессия на активированных эндотелиоцитах аллелей МНС II класса. Показано, что под влиянием IFN-γ на эндотелиоцитах в воспалительном очаге алелли HLA-DR экспрессируются на повышенном уровне, тем самым создавая условия для презентации антигенного материала и инициации аутоиммунного ответа [77].
Патогенез ХПВ неразрывно связан с реализацией разнонаправленной функциональной активности спектра провоспалительных цито- и хемокинов, продуцируемых как клетками воспалительного инфильтрата, так и доставляемых гематогенным и лимфогенным путём. Основными цитокинам, влияющим на функции эндотелиоцитов при ХПВ, являются IL-1α, IL-1β, IL-6, TNF-α TNF-β, IFN-α, IFN-β, IFN-γ, трансформирующий фактор роста β (TFG-β). К некоторым из них (IL-1β и TNF-α) эндотелиоциты конститутивно экспрессируют рецепторы. Под влиянием этих цитокинов происходит активация эндотелиоцитов с трансформацией в высокий эндотелий и экспрессией ряда мембранных молекул, включая Р- и Е-селектины, рецепторы L-селектинов и интегринов (ICAM-1, VCAM-1), а также секрецией провоспалительных цитокинов и хемокинов.
Важным свойством провоспалительных цитокинов, в изобилии продуцирующихся в очаге продуктивного воспаления при ревматических заболеваниях, является их прокоагулянтная активность. Известны широкие перекрестные связи между иммунной системой и системой гемостаза. При ХПВ, вирусных инфекциях эти связи сопровождаются усилением сосудисто-тромбоцитарного и коагуляционного гемостаза. Появился даже термин “иммунотромбоз” в связи с вирусом SARS-CoV-2. Результатом подобных процессов является распространённые микротромбы, имеющие существенное патогенетическое значение. IL-6 способствует продукции активированных тромбоцитов с последующей их агрегацией. TNF-α и IL-2 увеличивает продукцию ингибитора важного тромболитического фактора – плазминогена (PAI-1) с последующим усилением тромбообразования. IFN-γ усиливает продукцию тромбоцитов с тромбогенными эффектами [96].
Известна прокоагулянтная активность IL-1, обусловленная экспрессией на активированном эндотелии фактора III с последующим образованием микротромбов. IL-1 способствует экспрессии адгезионных молекул на эндотелии из группы интегринов и селектинов. Кроме этого, IL-1 стимулирует продукцию эндотелиоцитами сильного вазоконстриктора – эндотелина-1. Другой цитокин – IL-6, способствует пролиферации клеток КВИ. Цитокины из группы TNF и IFN усиливают экспрессию антигенов МНС I и II классов на клетках макрофагально-моноцитарного ряда. К патогенетически важным свойствам TNF-α нужно отнести стимуляцию неоангиогенеза и репарацию эндотелиоцитов в очаге воспаления. Сильным стимуляторами неоангиогенеза являются группа провоспалительных СХС-хемокинов (CXCL9 – CXCL16) и самый важный из них – IL-8. Кроме этого, IL-8 способствует привлечению и аттракции нейтрофилов в очаг воспаления и осуществления ими функции так называемых “нейтрофильных ловушек”, которые усиливают тромбообразование [101].
Очевидно, что адгезионные лиганд-рецепторные взаимодействия и связанные с этим процессы неоангиогенеза являются важными патогенетическими звеньями развития ХПВ и формирования КВИ. Гетерогенность взаимодействующих клеток и молекул подчёркивает многокомпонентность и взаимозависимость процессов. Исходя из представленной картины, весьма перспективны исследования в области таргетной терапии ИВРЗ, а также разработки методов оценки стадии и активности ИВРЗ.
1.5. Провоспалительные хемокины и цитокины
Хемокины представляют собой семейство небольших (8–10 кДа) хемотактических цитокинов, которые контролируют процессы миграции клеток врождённого и приобретенного иммунитета и являются ключевыми факторами формирования КВИ. В настоящее время идентифицированно более 50 хемокинов и 19 рецепторов хемокинов. Хемокины являются секретируемыми сигнальными белками и классифицируются на четыре основных группы в зависимости от местоположения остатков аминокислоты цистеина: хемокины группы XC (которые содержат один концевой цистеин), хемокины группы CC (которые имеют два соседних концевых цистеина), хемокины группы CXC (которые имеют два цистеина, разделенных одной другой аминокислотой) и хемокины группы CX3C (которые имеют два цистеина, разделенных тремя аминокислотами). Хемокиновые рецепторы представляют собой трансмембранные белки, которые связаны с цитоплазматическими G-белками и регулируют миграцию иммунных клеток. Эти рецепторы разделены на группы CCR, CXCR, XCR и CX3CR [59].