Проектирование медицинских изделий
4. ГОСТ Р МЭК 60601-1-2010 «Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик»
5. ГОСТ IEC 60601-1-8-2011 «Изделия медицинские электрические. Часть 1-8. Общие требования безопасности. Общие требования, испытания и руководящие указания по применению систем сигнализации медицинских электрических изделий и медицинских электрических систем».
6. IEC 60601-1-11:2010 "Изделия медицинские электрические. Часть 1-11. Общие требования безопасности с учетом основных функциональных характеристик. Дополнительный стандарт. Требования к медицинскому оборудованию и системам, используемым для ухода за больными в домашней среде.

6 Определение критериев спецификации дизайна изделия. Общие рекомендации
В этой главе будут рассмотрены основы спецификации дизайна продукта (product design specifcation, PDS), о которой мы говорили выше. Это важный момент для соответствия требованиям ISO 13485, в котором указано, что «для каждого типа или семейства медицинских изделий организация должна создать и поддерживать в рабочем состоянии один или несколько файлов, содержащих документы или дающих ссылки на них, для подтверждения соответствия требованиям настоящего стандарта и применимым регулирующим требованиям. Содержание файла (-ов) должно включать также спецификации продукции».
Многие изделия не достигают ожидаемых коммерческих и/или технических характеристик, что приводит к катастрофическим последствиям для производителя и неудовлетворенности потребителей.
Соблюдение простых рекомендаций может помочь производителям избежать часто встречающихся проблем, таких как:
– недостаточное знание рынка/целевого потребителя;
– недостаточное взаимопонимание между заказчиком и производителем;
– неадекватная норма прибыли;
– продукт слишком дорогой;
– несоблюдение нормативных требований;
– невыполнение целевых показателей эффективности;
– время выхода на рынок слишком велико;
– расходы на разработку слишком высоки;
– недостаточные внутренние навыки и знания для охвата процесса производства;
– чрезмерная гарантия, доставка или другие обязательства, создающие серьезные финансовые обязательства.
Спецификация требований к дизайну изделия четко определяет цель, функциональность, особенности и поведение медицинского изделия. Важно отметить, что она фокусируется на том, чего разработчик хочет достичь с помощью нового изделия, но не смотрит на то, как это сделать. Спецификация требований к дизайну изделия, созданная для новой идеи медицинского изделия, будет направлять остальную часть процесса проектирования и разработки. Это гарантирует, что проектировщики понимают, что ожидается и как будет измеряться успех изделия. Спецификация требований к дизайну изделия также позволяет показать, что изделие делает то, для чего оно было разработано. Спецификация также может помочь при соблюдении нормативных требований, поскольку демонстрирует правильность процесса проектирования.
Цель этой главы состоит в том, чтобы сосредоточить внимание на ключевых этапах создания спецификации дизайна медицинского изделия. При написании этой главы были адаптированы подходы из серии стандартов BS 7373-1:2001. Guide to the preparation of specification.
6.1 Термины и определения
Критерий – решающий фактор, мера или стандарт, по которому что-либо может быть оценено или принято решение.
Примечание к определению:
Это обычно выражается в терминах параметра с ограничениями или «да», или «нет».
Обзор дизайна – документированное, всестороннее и систематическое исследование изделия для оценки его способности выполнять требования к качеству и пригодности для цели, выявления проблем, если таковые имеются, и предложения разработки решений.
Спецификация эффективности – документ, определяющий совокупность потребностей, выраженных функциями, характеристиками, условиями процесса, границами и исключениями, определяющими характеристики изделия или процесса, включая требования к качеству.
Спецификация продукта – документация, в которой подробно описывается производство, конечное использование и другие цели соответствующего предмета.
Требование – потребность или ожидание, которое заявлено, обычно подразумевается или является обязательным.
Примечания к определению:
1. «Обычно подразумевается» означает, что это общепринятая практика для организации, ее клиентов и других заинтересованных сторон, что рассматриваемая потребность или ожидание подразумевается.
2. Определенный тип требований – например, требования к изделию, к управлению качеством, требования потребителя.
3. Установленное требование – это требование, которое установлено, например, в документе.
4. Требования могут создаваться различными заинтересованными сторонами.
Верификация – подтверждение посредством предоставления объективных доказательств того, что указанные требования были выполнены.
Примечания к определению:
1. Термин «верификация» используется для обозначения соответствующего статуса.
2. Подтверждение может включать такие действия, как:
– выполнение альтернативных расчетов;
– сравнение новой проектной спецификации с аналогичной проверенной проектной спецификацией;
– проведение испытаний и демонстраций;
– проверка документов перед выдачей.
Валидация – подтверждение путем предоставления объективных доказательств того, что требования для конкретного или предполагаемого использования приложения были выполнены
Примечания к определению:
1. Термин «валидированный» используется для обозначения соответствующего статуса.
2. Условия использования для валидации могут быть реальными или смоделированными.
6.2 Обоснование подготовки спецификации
6.2.1 Обзор
Легко стать одержимым инновационной идеей или новой технологией, не взирая на ее общую жизнеспособность или другие основания для ее реализации. Собрав достаточно информации для понимания потенциального изделия, можно должным образом оценить его жизнеспособность. Дисциплинированный сбор этой информации облегчает принятие решений, а также выявляет конфликты или компромиссы, позволяя разрешить их на ранней стадии и, таким образом, избежать проблем позже.
В этом разделе рассматриваются три основные области, которые необходимо понимать при принятии решений о разработке нового изделия. Это области:
1. коммерческие соображения;
2. характеристики эффективности изделия, необходимые для удовлетворения потребителя;
3. нормативные требования.
Только после того, как все требования к новому изделию будут поняты, можно рассмотреть, как обеспечить безопасное использование изделия и его качество. Таким образом, разработка спецификации предшествует обеспечению безопасности, качества и надежности.
6.2.2 Коммерческие соображения
Необходимо сделать обзор коммерческих вопросов, навыков и знаний, необходимых для вывода изделия на рынок. Должны быть определены потенциальный размер рынка и доля этого рынка, который является целевым. Последнее может иметь жизненно важное значение для определения жизнеспособности изделия. Следует также учитывать финансовые последствия для компании, особенно с точки зрения бюджетных ассигнований на программу развития и оборотного капитала.
Нужно продумать, как изделие попадает к покупателю (например, прямая продажа, агенты, дистрибьюторы, розничные торговцы), а также усилия по продвижению, которые будут необходимы. Эти усилия по продвижению следует понимать как с точки зрения развития связей с теми, кто продает изделие, так и с точки зрения развития связей с теми, кто производит рекламу изделия и литературу. При непрямых продажах, продажа агентам может потребовать таких же усилий, как и продажа конечному покупателю. Какой бы путь выхода на рынок ни был выбран, необходимо знать финансовые затраты на продажи и маркетинг. Это наверняка будет значительным вкладом в общую цену продажи.
При изучении этих и связанных с ними коммерческих вопросов становятся очевидными ключевые параметры, которые делают медицинское изделие успешным. Эта информация должна быть зарегистрирована, чтобы обеспечить наличие требуемых фактов. Запись этой информации снижает вероятность недоразумений и увеличивает шансы на принятие правильных проектных решений.
В случае с одноразовыми медицинскими изделиями или оборудованием специального назначения, когда обоснование или потребность кажутся очевидными, по-прежнему важно учитывать коммерческие вопросы.
6.2.3 Эффективность изделия
Должна быть собрана вся необходимая информация об особенностях эффективности изделия, которые делают новое изделие привлекательным и позволяют достичь целевых показателей эффективности. Эффективность используется здесь в самом широком смысле, чтобы включить в себя функциональность, качество, надежность и долговечность изделия и удовлетворенность пользователя, в том числе приемлемой ценой.
Запись этой информации для использования в документе со спецификацией позволяет дизайнерам найти подходящие проектные решения. В итоге спецификация предоставит критерии, по которым можно будет оценить эффективность изделия. Эти критерии испытаний и приемки обычно устанавливаются путем установления максимальных/минимальных пределов для каждого из соответствующих требований к изделию.
6.2.4 Нормативные требования
Медицинские изделия подпадают под действие нормативных актов, национальных стандартов. Необходимо понимать, какие именно правила и стандарты будут применяться. Это особенно важно во время разработки изделия, потому что способ выполнения проекта может иметь отношение к тому, какие правила или стандарты применяются или какие утверждения изделия могут потребоваться.
Пример 1. Стандарты7, которые могут быть применимы к изделию «Томограф компьютерный»:
– ГОСТ Р МЭК 60601-1-2010 «Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик»;
– ГОСТ Р МЭК 60601-1-2-2014 «Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания»;
– ГОСТ Р МЭК 60601-1-3-2013 «Изделия медицинские электрические. Часть 1-3. Общие требования безопасности с учетом основных функциональных характеристик. Дополнительный стандарт. Защита от излучения в диагностических рентгеновских аппаратах»;
– ГОСТ Р МЭК 60601-2-28-2013 «Изделия медицинские электрические. Часть 2-28. Частные требования безопасности с учетом основных функциональных характеристик медицинских диагностических рентгеновских излучателей»;
– ГОСТ Р МЭК 60601-2-44-2013 «Изделия медицинские электрические. Часть 2-44. Частные требования безопасности с учетом основных функциональных характеристик к рентгеновским компьютерным томографам»;
– ГОСТ IEC 60825-1-2013 «Безопасность лазерной аппаратуры. Часть 1. Классификация оборудования, требования и руководство для пользователей»;
– ГОСТ Р МЭК 62304-2013 «Изделия медицинские. Программное обеспечение. Процессы жизненного цикла»;
– ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования».
Пример 2. Стандарты, которые могут быть применимы к изделию «Набор реагентов для количественного определения ферритина в сыворотке и плазме»:
– ISO 18113-1 «Изделия медицинские для диагностики in vitro. Информация, представленная заводом-изготовителем (маркировки) – Часть 1: термины, определения и общие требования»;
– ISO 18113-2 «Изделия медицинские для диагностики in vitro. Информация, представленная заводом-изготовителем (маркировки) – Часть 2: Диагностические реагенты In vitro для профессионального использования»;
– ISO I5223-1 «Медицинские изделия – символы, использующиеся с медицинским изделием, этикетки, маркировки и предоставляемая информация – Часть 1: общие требования»;
– ISO 13485 «Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования»;
– EN 13612 «Оценка эффективности медицинских изделий для диагностики in vitro»;
– EN 62366 «Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности»;
– ISO 23640 «Тестирование на стабильность диагностических реагентов in vitro»;
– EN 13641 «Устранение или снижение риска инфицирования, связанного с применением медицинских изделий для in vitro диагностики»;
– EN 13975 «Методики выборочного исследования для приемочных испытаний медицинских изделий для диагностики in vitro»;
– ISO 14971 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям».
Таким образом, включение нормативных требований в спецификацию важно для успеха и признания изделия на рынке.
6.3 Определение критериев спецификации дизайна изделия
6.3.1 Обзор критериев, которые необходимо выбрать
Идентификация критериев неизбежно повторяется по мере того, как становится доступно больше информации и принимаются решения о потребностях пользователей, проектных решениях, деталях дизайна и способах производства изделия. Наиболее экономичный подход – сконцентрироваться на сборе конкретной информации, необходимой для принятия немедленных решений. Со временем больше критериев могут быть включены. Приоритизация критериев и получение правильных значений – это повторяющийся процесс на ранних этапах проектирования изделия.
В случае компромиссов, противоречащих друг другу требований или необходимости приоритизации вопросов использование развертывания функции качества (QFD) может быть полезным инструментом для помощи в принятии решений (см. внимание ниже).

QFD (Развертывание функции качества) – это методология, которая возникла на верфи Mitsubishi в Кобе в Японии, а затем была разработана и расширена компанией Toyota и ее поставщиками. Впоследствии его подхватили крупные американские производители автомобилей и другие ведущие компании в разных секторах, особенно в области электроники.
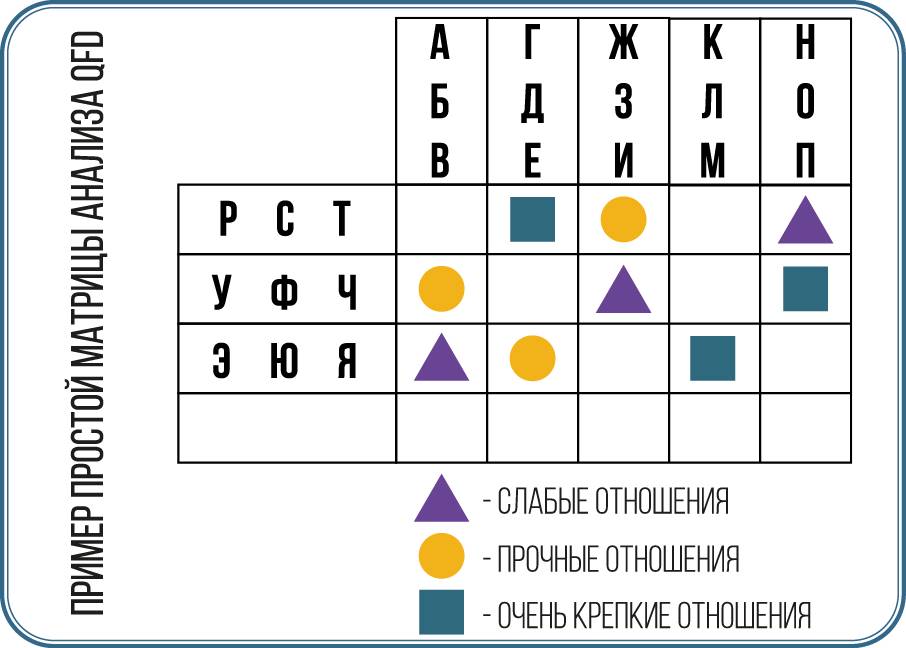
QFD – это инструмент, который помогает в разработке изделия/процесса от стадии концепции до его производства и далее. QFD особенно полезен для выявления критических требований заказчика и создания конкретных связей между этими требованиями и параметрами проекта. Метод использует матрицы для организации информации и помогает различным заинтересованным сторонам согласовать критические параметры и компромиссы. На рисунке в данном блоке показан типичный пример простой матрицы. Степень его использования будет зависеть от размера и сложности продукта/процесса. Это метод, который требует времени для освоения, но при правильном применении может принести существенные преимущества с точки зрения доли рынка, более конкурентоспособного продукта/процесса и обеспечения внесения изменений в конструкцию до начала производства или его изготовления, а не после.
Использование QFD при проектировании изделия/процесса может потребовать значительных затрат на начальном этапе с точки зрения времени, денег и персонала, которые уменьшаются по мере продвижения проектирования. Это контрастирует с более традиционным использованием ресурсов, которое начинается скромно и достигает пика по мере приближения к завершению проектирования. Как только команда освоит его использование, QFD-подход получит преимущества по сравнению с более традиционным подходом к проектированию изделия. Для тех, кто использует QFD впервые и/ или если сложное изделие, возможно, стоит подумать о привлечении эксперта в QFD для подготовки рекомендаций и советов.
QFD часто используется в сочетании с другими методами, такими как методы Тагути и принципы работы «точно в срок/всеобщее управление качеством» (JIT/TQM).
Одним из основных преимуществ QFD является практическое устранение изменений в работе, которые часто происходят на этапе проектирования/разработки, к тому времени, когда должно начаться производство. Более подробно мы рассмотрим эту методологию в следующих главах.

Важно учитывать весь жизненный цикл изделия, а не только концентрироваться на эксплуатации пользователем. Это означает, что нужно думать о рынке, разработке изделия, производстве, упаковке, распространении, использовании, обучении, техническом обслуживании, ремонте, повторном использовании, переработке, утилизации и о том, как каждый из этих этапов может повлиять на конструкцию (рисунок 6.1).
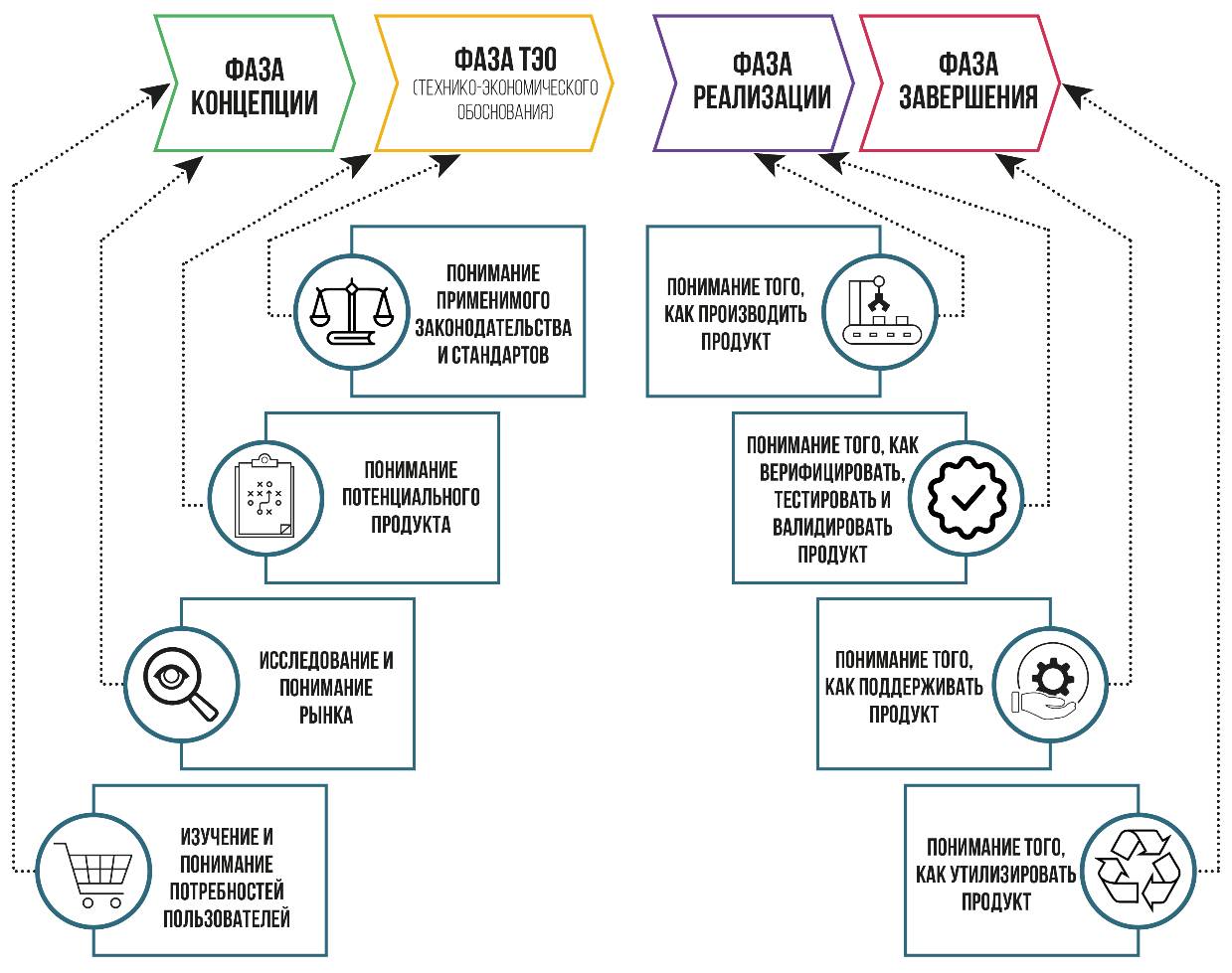
Рисунок 6.1 – Этапы идентификации критериев изделия
При оценке того, какие критерии относятся к отдельному изделию, рекомендуется не только использовать контрольные списки, приведенные в рекомендациях ниже, но и рассматривать любые другие вопросы, имеющие решающее значение для успеха изделия и удовлетворения клиентов. Важно, что если информация получена, то она должна быть записана.
6.3.2 Идентификация потребителей
Все изделия будут иметь потребителя, иными словами, конечного пользователя. Часто бывает очень трудно найти фактического конечного пользователя, поскольку человек, который инициирует потребность, может на самом деле не быть конечным пользователем. Точно так же человек, который на самом деле покупает изделие, может не быть конечным пользователем
Тем не менее в рамках спецификации дизайна изделия необходимо определить основные и второстепенные группы потребителей. Основными потребителями являются те, кто напрямую использует изделие. К второстепенным потребителям могут быть отнесены все, кто может взаимодействовать с изделием.
Вероятно, у разработчика продукции уже есть общее представление о том, кто такие основные потребители, например пациенты, медсестры, врачи, техники, фельдшеры или какая-либо другая группа. Но второстепенные потребители могут быть не так очевидны. Тем не менее их потребности могут быть столь же критически важны для функции изделия или качества ухода пациента.
Например, это специалист, который стерилизует, калибрует и проводит предоперационную проверку аппарата ИВЛ, прежде чем передать его основному пользователю. Он не управляет аппаратом искусственной вентиляции легких. Дополнительные второстепенные потребители могут включать административный персонал, инструкторов, монтажников или обслуживающий персонал.
Определение групп пользователей на высоком уровне – это только начало. Некоторые производители медицинского оборудования останавливаются на достигнутом. Они просто работают с основной группой пользователей по профессии (например, «медработник»). Но этого недостаточно, чтобы сказать, какие медсестры будут управлять изделием и кого включить в исследования.
Чтобы проиллюстрировать, почему профессиональных званий недостаточно, рассмотрим пример. Допустим, компания разрабатывает аппарат для искусственной вентиляции легких. Пульмонологи будут основной группой пользователей. Было бы легко думать о пульмонологах как о единой группе. Но это заблуждение.
Безусловно, у всех разный уровень экспертизы. К примеру, один – опытный пульмонолог, который более 25 лет работает в отделении интенсивной терапии крупной больницы. За это время он получил степень доктора наук и имеет опыт использования большинства аппаратов ИВЛ на рынке. В результате он является экспертом. Когда у других сотрудников есть вопросы о любом аппарате ИВЛ в больнице, обращаются к нему. Второй – 25-летний пульмонолог, который недавно начал работать в небольшой сельской больнице. Он является ассистентом, прошел обучение по нескольким различным маркам аппаратов ИВЛ. У него есть реальный опыт работы с одной моделью, которую он использовал у пациентов за последний год. Оба технически пульмонологи, но у них разный опыт и знания.
Если компания разработает свой продукт исключительно для опытного пульмонолога, то менее опытному врачу будет сложно. Поэтому так важно создать профиль пользователя, который описывает подробные характеристики групп пользователей, о которых нужно узнать больше.
Надежный профиль пользователя должен включать следующую информацию о пользователе:
– занятость;
– демография;
– конкретные навыки, знания и уровень образования;
– физические и/или когнитивные ограничения;
– предпочтения производительности и стили обучения;
– обязанности и задачи, связанные с изделием или процедурой.
Можно нарисовать образ личности пользователя. Личность – это вымышленный человек, который имеет характеристики типичного пользователя. Создание профилей персонажей, как и описания пульмонологов выше, действительно может помочь команде дизайнеров понять пользователей.
Пользовательские задачи в настоящее время «рекомендуются», а не требуются в документе спецификации использования. Но если есть желание обеспечить удобство пользования изделием, надо считать это обязательным элементом спецификации.
В начале процесса разработки это может быть так же просто, как предварительный список задач. Важно учесть следующие моменты:
– отраслевые стандартные операционные процедуры;
– существующие или сопоставимые изделия, уже имеющиеся на рынке;
– функциональные требования;
– пользовательские истории.
Концепция универсального/доступного дизайна должна быть реализована с учетом максимально широкого круга пользователей, включая детей, пожилых людей и людей с ограниченными возможностями. Рекомендации по учету этих групп доступно в Руководстве ИСО/МЭК 71.
6.3.3 Изучение и понимание потребностей пользователей
После идентификации пользователей необходимо получить информацию об их требованиях. Критерии, которые уже установлены или будут установлены, должны включать те, которые сделают изделие успешным. Скорее всего, они будут выражены в общих чертах, но любые ограничения на такие параметры, как размер, вес, шум, мощность, цвет или внешний вид, должны быть включены везде, где это возможно. Следует подчеркнуть характеристики изделия, которые дают рыночное преимущество перед конкурентами.
Ключевым вопросом является обеспечение того, чтобы «голос пользователя» был услышан во всей организации, в частности теми, кто участвует в разработке нового продукта.
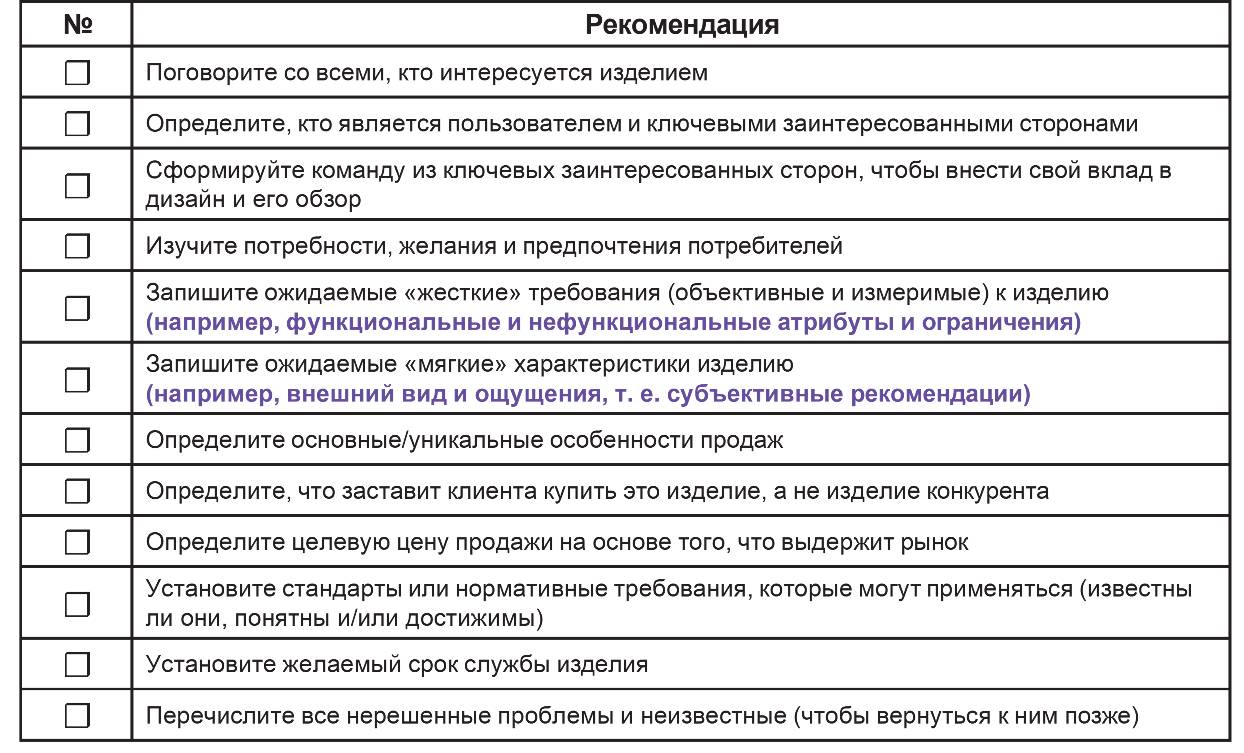
Проведение маркетинговых исследований помогает определить потребности пользователей, новые рыночные ниши и приемлемость для клиентов. Инициирование тестирования прототипа, пользовательских испытаний, фокус-групп и групп пользователей с привлечением потребителей, где это необходимо, помогает добиться окончательного принятия модели. В таблице 6.1 приведен рекомендуемый список рекомендаций для использования при определении потребностей пользователей.
Таблица 6.1 – Список рекомендаций при установлении потребностей пользователей
6.3.4 Исследование рынка
Чтобы оценить коммерческую жизнеспособность изделия, следует понимать размер рынка, конкуренцию, бюджетные требования, финансовые ресурсы, возврат инвестиций, окно возможностей и время выхода на рынок. Эта информация позволяет сделать выводы о том, как и где продавать изделия, о необходимых сроках, его надежности и качестве. Все эти выводы являются критериями, которые в итоге должны быть включены в спецификацию.
В таблице 6.2 приведен список рекомендаций при определении рынка, информации о конкурентах и коммерческой жизнеспособности.
Таблица 6.2 – Контрольный список для использования при определении рынка, информации о конкурентах и коммерческая жизнеспособность

6.3.5 Понимание среды использования
Чтобы создать удобное изделие, нужно понимать среду, в которой оно будет использоваться чаще всего. В мире медицинских изделий окружающая среда изделия может варьироваться от лаборатории или хирургического отделения больницы до дома пациента (рисунок 6.2).