
Реабилитация при болезни Паркинсона
Существует теория, что сварка может ускорять дебют БП, так как в процессе сварки образуются сложные металлические аэрозоли, ингаляция которых связана с неблагоприятным воздействием на нейроны. Так например, K. Sriram и соавт. (2010) на примере лабораторных крыс подтвердили дофаминергическую нейротоксичность марганца сварочного дыма.
J.M. Kim и соавт. (2010) показали роль мутации генов белков JMG2385R (rs34778348) и R1628P (rs33949390), богатых лейцином повторной киназы 2 (LRRK2, PARK8), в развитии спорадической формы БП среди населения Китая и Японии. В исследование были включены 923 пациента с БП и 422 здоровых лиц. Полиморфизм гена LRRK2 G2385R был обнаружен у 82 пациентов с БП (8.9% – гомозигота и 80% гетерозигота) и у 21 человека из группы контроля (5.0%, – все гетерозиготы). Частота встречаемости мутаций гена LRRK2 G2385R среди больных БП была значительно выше, чем в группе контроля. Гендерные различия между здоровыми носителями мутации G2385R и пациентами с БП, не имеющими исследуемую мутацию, а также разница среднего возраста начала заболевания, не выявлены. Мутация гена LRRK2 (R1628P аллельный вариант) встречалась значительно реже (0,78% у больных БП, 0,26% в группе контроля).
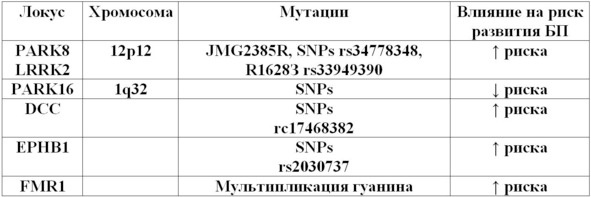
Таб. 3. Мультифакториальные формы БП.
На сегодняшний день роль наследственного фактора в развитии БП несомненна, при всем изобилии генетических детерминант современные представления о БП базируются на том, что данное состояние является, прежде всего, мультифакториальным заболеванием (таб. 3), и наличие того или иного варианта мутации, может способствовать как повышению, так и снижению риска развития БП (таб. 4, 5). Кроме того, генетический фактор играет более важную роль в развитие БП с ранним началом.
Внешние факторы, способные влиять на риск развития БП, можно распределить на 3 группы: 1) уменьшающие риск развития БП (физическая активность, употребление алкоголя, курение, работа вне помещения, употребление кофе, витамина E, гипертензия, нестероидные противовоспалительные препараты, блокаторы кальциевых каналов, статины); 2) увеличивающие риск БП (пожилой и старческий возраст, мужской пол, семейная агрегация БП, генетический компонент, углеводороды, занятие сельским хозяйством, органические растворители, пестициды, проживание в сельской местности, употребление молочных продуктов, колодезной воды, запоры, травмы головы, беспокойство, депрессия, остеопороз, лечение бета-блокаторами); 3) не оказывающие никакого влияния (магнитное поле сверхнизкой частоты, марганец, сварочные аэрозоли; употребление холестерина, углеводов, протеинов, жиров, чая, фолатов, витаминов A, B6, B12, C, D; сахарный диабет, рак, язвенная болезнь желудка, овариэктомия, подагра, общая анестезия, оральные контрацептивы, гормонозаместительная терапия в менопаузе).
Некоторые факторы, влияющие на риск возникновения БП, можно считать установленными, остальные – необходимо исследовать в будущем, так как влияние тех или иных внешних факторов на риск развития БП имеет различную степень доказательной базы.
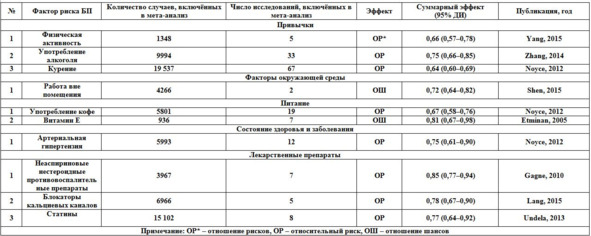
Таб. 4. Факторы, уменьшающие риск развития БП.
Один из внешних факторов, который может быть потенциально связан с БП – это сверхнизкочастотные магнитные поля (СНМП). Поскольку многие работники подвергаются воздействию этих полей в дозах выше предельно допустимого уровня, такое излучение способно оказывать серьёзное влияние на общественное здоровье. Исследователи оценили действие СНМП на население и на профессионалов и получили противоречивые данные: одни результаты свидетельствовали о наличии связи СНМП с риском БП, другие – о её отсутствии. Мета-анализ не выявил увеличения риска БП из-за СНМП.
Несмотря на то, что имеются отдельные сообщения об ассоциации больших количеств марганца с развитием атипичного паркинсонизма, связь марганца с обычной формой БП более противоречива. Сварщики подвергаются воздействию марганца в составе сварочных аэрозолей, но остаётся неясным, достаточны ли его уровни для увеличения риска БП. Результаты мета-анализа данных когортных и кейс-контрольных эпидемиологических исследований показали, что сварочные аэрозоли и воздействие марганца не повышают риск БП.
В ряде работ выявлена положительная связь между воздействием углеводородов и развитием БП. Точный механизм потенциальной нейротоксичности углеводородов пока ещё неясен, хотя в экспериментах на животных установлен ряд повреждающих эффектов. У пациентов с БП и длительным воздействием органических растворителей в анамнезе при магнитно-резонансной спектроскопии были обнаружены повреждения нейронов полосатого тела, в то время как у лиц, не подвергавшихся действию этих веществ, подобных повреждений не найдено. Высказано предположение о существовании селективной чувствительности базальных ганглиев к повреждающему эффекту органических растворителей, которая подтверждалась статистически значимой зависимостью между уровнем их воздействия и степенью повреждения нейронов. По мнению некоторых авторов влияние углеводородов статистически значимо снижает связывание переносчика дофамина в наружной части чечевицеобразного ядра полосатого тела. Возможно, нейродегенерация возникает в результате сочетанного эффекта генетических и внешних факторов. Есть доказательства того, что генетические полиморфизмы ферментов, расщепляющих ксенобиотики, имеют значение для нейротоксичности углеводородов. Кроме того, предполагается, что в результате метаболизма углеводородов могут образовываться токсичные промежуточные соединения, которые индуцируют митохондриальную дисфункцию посредством усиления оксидативного стресса, что увеличивает риск БП.
В некоторых работах показан повышенный риск БП у лиц, проживающих в сельской местности и занимающихся сельским хозяйством. Эти данные могут быть объяснены влиянием пестицидов и других химических веществ. Литературные источники подтверждают гипотезу о том, что действие пестицидов или растворителей является фактором риска БП. Существует широкий спектр пестицидов, имеющих различный химический состав и механизм действия. Получены результаты, свидетельствующие о том, что гербициды и инсектициды, но не фунгициды, ассоциируются с развитием БП. Вместе с тем трудно разграничить эффекты гербицидов и инсектицидов, поскольку эти группы пестицидов, как правило используются одновременно. При этом работа вне помещения связана с уменьшением риска БП, что обусловлено, вероятно, большим количеством витамина D в организме людей, работающих на открытом воздухе.
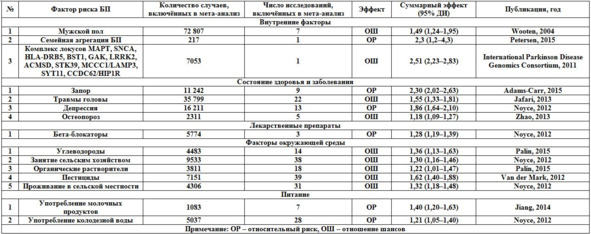
Таб. 5. Факторы, увеличивающие риск развития БП.
В проспективном исследовании было установлено, что средний уровень дневной физической активности ассоциировался с пониженным риском БП. Её защитную роль при БП подтвердили эксперименты на животных, свидетельствовавшие о том, что принудительная физическая активность оберегает дофаминергические терминали и уменьшает двигательные аномалии. На крысиных моделях БП принудительные упражнения повышали содержание глиального нейротрофического фактора GDNF (который оказывал протективный эффект на дофаминергические нейроны, или снижал соотношение между переносчиком дофамина и белком-переносчиком везикулярного моноамина, что делало дофаминергические нейроны менее чувствительными к токсинам); а также восстанавливали дофаминергическую систему и увеличивали работоспособность дофаминергических нейронов в стриатуме, возможно посредством усиления высвобождения везикулярного дофамина или экспрессии D2-рецепторов. Предполагается, что у людей физические упражнения повышают уровень уратов в плазме, что, в свою очередь, ассоциируется с меньшим риском БП и более медленным прогрессированием заболевания. Кроме этого, отсутствие физической активности приводит к набору веса или ожирению, что вызывает уменьшение экспрессии D2-рецепторов в полосатом теле и тем самым увеличивает риск БП. Хотя потенциальные механизмы влияния различных типов физической активности полностью не ясны, исследования людей и животных демонстрируют её благоприятный биологический эффект в отношении риска развития БП. В проспективном исследовании 2014 года с участием 43000 человек продемонстрировано, что физическая активность в течение 6 часов в неделю уменьшает риск развития БП на 43% по сравнению с 2 часами физической активности.
В результате мета-анализа выявлено, что употребление алкоголя уменьшает риск БП и ассоциация связана с пивом в большей степени, чем с вином и крепкими напитками. Обратная связь риска БП и приёма алкоголя установлена у мужчин, но не у женщин. Употребление в день 50 г крепкого алкоголя на 5% снижает риск БП. Показано, что обратная связь приёма алкоголя с риском БП ослабевала, но оставалась значимой после корректировки по курению и по употреблению кофе.
Приём алкоголя может воздействовать на риск возникновения БП непосредственно или путём влияния на содержание мочевой кислоты в сыворотке крови, поскольку уровень этого показателя обратно связан с развитием БП и способен отсрочить её прогрессирование.
Результаты мета-анализа свидетельствуют, что курение является протективным фактором в отношении развития БП. Кроме того, установлена статистически значимая обратная зависимость риска БП от индекса курения. Табак и табачный дым содержат более 9000 химических компонентов, среди которых именно никотин стимулирует дофаминергические нейроны, тем самым обладая нейропротективным действием. Никотин оказывает эффект на периферическую и центральную нервную систему, стимулируя никотиновые ацетилхолиновые рецепторы. D.P. Hong и соавт. исследовали влияние никотина и 4 других компонентов сигаретного дыма (анабазин, котинин, гидрохинон и норникотин) на фибрилляцию αSyn белка, который агрегируется в тельцах Леви при БП наряду с другими белками.
Никотин и гидрохинон ингибируют образование αSyn фибрилл (при этом никотин более эффективен). Эти составляющие стабилизируют растворимые олигомерные формы αSyn.
Некоторые специалисты предполагают, что фермент моноаминоксидаза B (MAO-B), который играет роль в биоактивации индуцирующего паркинсонизм нейротоксина 1-метил-4-фенил-1,2,3,6-тетрагидропиридина, ингибируется в мозгу курильщиков.
Ожирение – хорошо известный фактор риска различных метаболических и сосудистых расстройств. В результате мета-анализа 10 проспективных исследований не обнаружено ассоциации между индексом массы тела и риском БП. Мета-анализ выявил, что наличие в анамнезе травм головы, сопровождавшихся потерей сознания, статистически значимо связано с повышенным риском БП. Предложено несколько возможных механизмов этой взаимосвязи. Наиболее правдоподобным представляется нейровоспаление, вызванное травмой, которое вносит вклад в патогенез БП. Травма головы может привести к разрушению гематоэнцефалического барьера и вызвать лейкоцитарную инфильтрацию и активацию микроглии, а также нарушение функции митохондрий и усиление интоксикации глутаматом, что способствует развитию нейродегенеративных заболеваний, в том числе БП. Тяжёлые травмы головы следует рассматривать в качестве одного из основных факторов возникновения БП.
Связанный с БП запор может быть обусловлен образованием телец Леви в нервной системе кишечника или дорсальных двигательных ядрах блуждающего нерва, которые поражаются в наиболее ранние сроки развития БП. При исследовании в группе пожилых мужчин редкие движения кишечника по данным самооценки были связаны с высоким риском БП и уменьшением плотности нейронов чёрной субстанции. Является ли запор самостоятельным фактором риска БП или ранним симптомом в продромальной фазе заболевания, остаётся предметом споров. Наличие запора, наряду с другими немоторными симптомами, способно служить признаком для идентификации индивидуумов с повышенным риском БП.
Результаты когортных исследований сахарного диабета, как фактора риска БП противоречивы. В некоторых работах выявлены статистически значимая положительная ассоциация риска БП с беспокойством и депрессией и значимая отрицательная ассоциация с артериальной гипертензией. Расстройства настроения связаны с вовлечением ствола мозга, что (наряду с вовлечением обонятельного центра) случается в ранней фазе БП. Наиболее выраженными факторами риска развития БП были семейный анамнез БП и тремор. Не установлено связи риска БП с раком.
Наличие хирургической менопаузы существенно изменяло риск БП, но необходима дальнейшая работа в этом направлении, так как исследования случай-контроль продемонстрировали статистически значимое снижение риска, а когортные – его статистически значимое увеличение.
Предполагалось, что Helicobacter pylori – возможный фактор риска БП, однако исследования этой связи отсутствуют. Вместе с тем не выявлено ассоциации предшествующей язвенной болезни желудка (которая может быть суррогатным маркёром данной инфекции) с последующим развитием БП. Мочевая кислота является антиоксидантом, а гиперурикемия коррелирует с пониженным риском БП; но при мета-анализе не обнаружено обратной связи между подагрой и риском БП. Результаты некоторых исследований свидетельствуют, что риск развития остеопороза выше у пациентов с БП по сравнению со здоровыми лицами контрольной группы, а также у мужчин с БП по сравнению с женщинами, страдающими этим заболеванием.
Мета-анализ указывает на то, что у пациентов с БП плотность кости в области таза, поясничных позвонков и шейки бедра ниже, чем у здоровых лиц референтной группы.
Приём бета-блокаторов увеличивал риск развития БП. Это, однако, можно объяснить их применением для лечения изолированного тремора. Блокаторы кальциевых каналов ассоциированы с уменьшением риска.
При исследовании статинов также был продемонстрирован тренд снижения риска БП, который может быть обусловлен их протективным эффектом в отношении оксидативного стресса. Приём нестероидных противовоспалительных препаратов уменьшал риск БП примерно на 17%, что свидетельствует о существенной роли воспаления в патогенезе этого заболевания. Не было обнаружено никакой связи между приёмом оральных контрацептивов или гормонозаместительной терапией в менопаузе (постменопаузе) и развитием БП, хотя эти вопросы требуют дальнейшего изучения, поскольку исследования случай-контроль показали статистически значимое снижение риска, тогда как когортные – его статистически значимое повышение.
Патоморфологические стадии развития болезни Паркинсона
В настоящее время существует концепция постадийного клинического развития БП, в основу которой легла гипотеза H. Braak, сформулированная в 2003 году. Согласно этой гипотезе, основанной на патоморфологическом изучении – синуклеин-содержащих изменений, у больных с различной тяжестью БП и лиц, не имеющих при жизни признаков паркинсонизма, болезнь прогрессирует на протяжении 6 стадий. Нейродегенеративный процесс при БП может начинаться с появления телец Леви в периферических вегетативных мезентериальных сплетениях, распространяясь центропетально, затем восходя от каудальных отделов головного мозга к коре (Таб. 6).

Таб. 6. Патоморфологические стадии развития болезни Паркинсона (по Braak et al., 2003).
На I стадии патологический процесс затрагивает дорсальное моторное ядро Х нерва, обонятельную луковицу с прилегающей частью переднего обонятельного ядра, что обуславливает появление в клинической симптоматики самых ранних признаков заболевания – гипосмию и дисфункцию желудочно-кишечного тракта (констипацию).
На II стадии при распространении дегенеративного процесса на ядра шва, части ретикулярной фармации и голубоватое пятно появляются сенсорные изменения, в частности, болевые проявления, эмоциональные расстройства.
На III стадии процессом затрагивается черная субстанция, но без гибели нейронов, а также миндалина, педункулопонтинные ядра, оральное ядро шва, холинэргические магноцеллюллярные ядра базальных отделов переднего мозга, туберомамиллярные ядра гипоталамуса, что проявляется нарушением REM-фазы сна (rapid eye movement – быстрые движения глаз, т. е. фаза быстрого сна), аффективными расстройствами, депрессией.
На IV стадии происходит снижение количества нейронов в компактной части черной субстанции, приводящее к двигательным нарушениям. Кроме того, на этой стадии в патологический процесс вовлекается переходная зона между древней и новой корой, через которую следуют проекции первичных зон коры к префронтальной коре, что влечет за собой когнитивный дефицит в виде ослабления памяти и утраты личностной инициативы, проявления вторичной лобной дисфункции.
На V стадии происходит нарастание когнитивных нарушений с одновременным появлением психотических расстройств вследствие вовлечения в процесс структур неокортекса, прежде всего, ассоциативных зон в префронтальной, височной и теменной коре.
На VI стадии происходит усугубление изменений в ранее пораженных структурах с вовлечением первичных сенсорных и моторных зон коры. О «периферическом» генезе БП стали говорить, когда было показано, что в латентном периоде БП нейродегенеративные «паркинсонические» изменения (агрегаты α-синуклеина, тельца Леви) выявляются в периферических вегетативных нейронах: в клетках нервных сплетений кишечника, пре- и паравертебральных ганглиях, в дистальных симпатических терминалях и ганглиях симпатического ствола, нейронах надпочечников, слюнных желез, кожи и т. д.. Одной из теорий предполагается, что вовлечение парасимпатических интрамуральных нейронов кишечника и клеток обонятельных ядер может быть наиболее ранними патологическими событиями при БП, которые указывают на возможность вдыхания и/или алиментарного поглощения триггерного патогена. Дальнейшее распространение патологического процесса может происходить по волокнам обонятельного и блуждающего нервов (с поражением соответствующих нейронов каудального ствола), а также по механизмам ретроградного аксонального транспорта (в периферической вегетативной нервной системе – см. рис. 7).
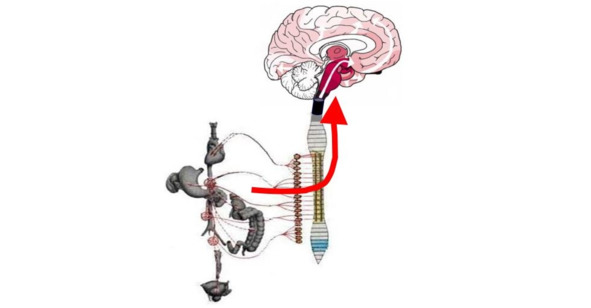
Рис. 7. Патоморфологическая стадийность БП.
Клинические стадии развития болезни Паркинсона
В классификации БП выделяют клиническую форму, стадию и темп прогрессирования.
В зависимости от доминирования в клинике того или иного симптома выделяют три клинических формы: акинетико-ригидно-дрожательную (60—70%), акинетико-ригидную (15—20%) и дрожательную (5—10%).
В отношении клинической стадии заболевания общепризнанной является следующая классификация стадий (степеней тяжести) БП:
Стадия 0. Двигательные проявления отсутствуют;
Стадия 1. Односторонние проявления заболевания;
Стадия 2. Двусторонние проявления заболевания без постуральной неустойчивости;
Стадия 3. Умеренно выраженная постуральная неустойчивость, возможно самостоятельное передвижение;
Стадия 4. Значительная утрата двигательной активности, но пациент в состоянии передвигаться;
Стадия 5. При отсутствии посторонней помощи пациент прикован к постели или инвалидному креслу.
Выделяют также модифицированную шкалу Хен и Яр (Hoehn, Yahr, 1967), которая впервые была опубликована в журнале «Neurology» Маргарет Хён и Мелвином Яром и официально утверждена в 1967 году.
Модифицированная шкала Хен и Яр
Стадия 0.0 – нет признаков паркинсонизма (данная стадия характеризуется отсутствием клинических проявлений заболевания, однако в центральной нервной системе уже начинаются структурные изменения. Болезнь на этой стадии диагностируется очень редко, как правило, случайно);
Стадия 1.0 – только односторонние проявления (у больных наблюдают односторонний тремор кисти руки, тремор имеет слабо выраженный характер. По мере прогрессии появляются изменения осанки, мимики лица, походки, может появляться боль в плечевом суставе на стороне поражения. Также может появиться ощущение «песка в глазах», вследствие сокращения количества мигательных движений век. У пациентов увеличиваются затраты времени на бритье, расчесывание и другие ежедневные манипуляции);
Стадия 1.5 – односторонние проявления с вовлечением аксиальной мускулатуры (происходят локомоторные изменения, сокращение амплитуды движений, появляется выраженная ригидность мышц лица и шейного отдела);
Стадия 2.0 – двухсторонние проявления без признаков нарушения равновесия (расстройства носят двусторонний характер и проявляются дрожанием кистей рук, недостаточной амплитудой и скованностью. Возникает непроизвольное покачивание головы, а ригидность лицевой мускулатуры приводит к гипомимии («маскообразное» лицо);
Стадия 2.5 – мягкие двухсторонние проявления. Сохранена способность преодолевать вызванную ретропульсию;
Стадия 3.0 – умеренные или средней тяжести двухсторонние проявления. Небольшая постуральная неустойчивость. Но больной не нуждается в посторонней помощи (становится более выраженной ретропульсия. У пациентов прогрессирует скованность движений, в результате потери равновесия возможны падения. При ходьбе больной прижимает руки к телу, сокращается длина и высота шага – признак «шаркающей» походки. Несмотря на симптоматику, человек продолжает себя обслуживать, сохраняется частичная способность работать);
Стадия 4.0 – тяжёлая обездвиженность; однако ещё может ходить или стоять без поддержки (развивается значительная гипокинезия, выраженный тремор головы и конечностей. Иногда тремор уменьшается. Больной не в состоянии выполнять физическую работу, уход за собой вызывает существенные затруднения. Движения выполняются с трудом, походка становится очень медленной. На этом этапе пациенту необходимы дополнительные средства, чтобы поддерживать равновесие – трость, костыли, ходунки);
Стадия 5.0 – без посторонней помощи прикован к креслу или кровати (данная стадия заболевания характеризуется потерей возможности самостоятельно передвигаться. Больной перемещается при помощи инвалидного кресла, либо он все время лежит в кровати. С этого момента человек нуждается в постоянном уходе со стороны близких или медицинского персонала. Появляются выраженные нарушения глотательной функции, что ведет к потере веса).
Кроме того, при БП принято выделять три вида темпа прогрессии заболевания: быстрый, умеренный и медленный. При быстром темпе смена стадий заболевания (первая – вторая/вторая – третья) происходит в течение 2 и менее лет. При умеренном темпе смена стадий происходит более чем за 2 года, но не более чем за 5 лет. При медленном темпе смена стадий происходит более чем через 5 лет.
Клиническая картина болезни Паркинсона
Клинические проявления БП принято разделять на моторные и немоторные. Среди моторных симптомов заболевания следует выделить: брадикинезию, ригидность, тремор покоя, постуральную неустойчивость. К немоторным проявлениям БП относят: нарушения обоняния, вегетативные проявления (дисфункция желудочно-кишечного тракта, мочеиспускания, половую дисфункцию, нарушение потоотделения, постуральную гипотензию, себорею), аффективные нарушения, нарушения сна, психотические нарушения, когнитивные нарушения.
Гипо- или брадикинезия при БП.
Брадикинезия при БП проявляется замедленностью движений, уменьшением амплитуды движений, нарушением инициации движений, истощаемостью (декремент) движений, асимметрией (в начале болезни может быть только в одной конечности или ее сегменте), гипомимией, редким миганием, укорочением длины шага, замедленностью ходьбы, затруднением при вставании, поворотах и т. д., микрографией, нарушением мелких движений (чистка зубов, печатание, набор номера телефона), брадилалией, гипофонией, диспросодией (монотонность), иногда тахифемией (ускоренная речь с элементами многословия).
Для стереотипа походки при БП характерны следующие признаки: приволакивание одной ноги при ходьбе, ахейрокинез (симптом ролекса), микробазия (укорочение шага), шарканье, ускорение ходьбы – за счет частоты шагов, пропульсии, пародоксальные кинезии, застывания (freezing) – чаще при изменении программы ходьбы, топтание на месте.
Мышечная ригидность при БП.
Мышечная ригидность при БП может иметь следующие характеристики: пластический тип, тип «зубчатого колеса», развивается во всех мышечных группах (агонисты и антагонисты), в аксиальной мускулатуре, нарастает по мере проверки, асимметрична, в начале болезни чаще представлена в дистальных отделах рук, в шее, усиливается при движениях в других конечностях.