
Реабилитация при болезни Паркинсона
Апатия является отдельным симптомом БП, который может возникать вне зависимости от наличия депрессии, сонливости и утомляемости, хотя иногда сочетается с депрессией или тревожным расстройством. Пациенты с БП имеют более высокий уровень апатии по сравнению с пациентами с остеоартритом с аналогичной степенью дезабилитации. Хотя в основе апатии, вероятно, лежит дофаминергическая дисфункция, не исключается вовлечение и других нейротрансмиттерных путей, и ее не всегда удается устранить дофаминергическими препаратами.
Нарушения сна. Диссомния при болезни Паркинсона.
Практически все пациенты с БП имеют нарушения сна уже на ранних стадиях заболевания в виде трудностей засыпания, частых пробуждений, ночной скованности, болезненных дистоний, периодических движений конечностей во сне, выраженной дневной сонливости и др. Причиной их возникновения предположительно является дегенерация центральных стволовых структур и таламокортикальных путей. Нарушение REM-фазы сна наблюдается у 1/3 пациентов с БП, представляя собой парасомнию, с потерей нормальной атонии скелетной мускулатуры, что позволяет пациенту физически осуществлять свои сны. Сон сопровождается вокализациями (разговор, крик) и движениями (подергивания рук и ног, падения с кровати, нападение), которые соответствуют содержанию снов, обычно носящих негативный и яркий характер. Более чем у 30% пациентов с БП имеются полисомнографические критерии нарушения REM-фазы сна, а более чем у 50% – его эпизоды без атонии. Нарушение REM-фазы сна может задолго предшествовать развитию двигательного паркинсонизма у пациентов с БП. Наблюдение за 29 пациентами с идиопатическим нарушением REM-фазы сна показало, что через 4 года БП развилась у 39% пациентов, а через 7 лет – у 60%. У пациентов с идиопатическим нарушением REM-фазы сна имеется симметричное снижение захвата дофамина в стриатуме, что может свидетельствовать о преклинической БП. Вероятно, нарушение REM-фазы сна может возникать по причине дегенерации ядер нижних отделов ствола, обеспечивающих нормальную атонию в REM-фазе сна (педункулопонтинное ядро, голубоватое место, ретрорубральное ядро), что характерно для стадий I и II по Брааку.
Выраженная дневная сонливость наблюдается у 50% пациентов с БП, значительно влияя на качество их жизни. Сонливость вызывает нарушение концентрации внимания, ухудшение памяти, может явиться причиной дорожно-транспортных происшествий и травм. Причиной сонливости может быть заболевание само по себе, фрагментация ночного сна, побочные эффекты антипаркинсонических препаратов. У ряда пациентов прием дофаминовых агонистов может вызвать эпизоды внезапной сонливости. Предполагается существование вторичной нарколепсии без катаплексии при БП, связанной с дегенерацией гипокретиновых (орексиновые) нейронов гипоталамуса.
Вегетативные нарушения при болезни Паркинсона.
Вегетативные нарушения включают ортостатическую гипотензию, дисфункцию мочевого пузыря, половые нарушения, запоры, гипергидроз и др. В основе их развития лежит дегенерация вегетативных центров – дорсального ядра блуждающего нерва, двоякого ядра, вегетативных центров продолговатого мозга и др. Вегетативные нарушения широко распространены на всех стадиях БП. Так, ортостатическая гипотензия имеется у 30% больных, задержки мочеиспускания – у 32%, запоры – у 36%. Снижение систолического артериального давления при ортостатической пробе более чем на 20 мм. рт. ст. выявлено у 58% пациентов с БП, а у 20% – ортостатическая гипотензия была симптоматической и коррелировала с длительностью БП и приемом дофаминергических препаратов. Возможна ранняя денервация сердца при БП, обусловленная накоплением αSyn.
Запор является одним из наиболее распространенных немоторных симптомов БП и часто предшествует развитию заболевания. Распространенность запоров у пациентов с БП достигает 60% по сравнению с контролем (6—33%). Показано, что через 10 лет после начала запоров риск развития БП в 3 раза выше по сравнению со здоровыми. Возникновение запоров еще на I стадии по Брааку может объясняться поражением дорсального ядра блуждающего нерва. В патологический процесс вовлекается также сплетение Ауэрбаха с симпатической денервацией кишечника. Гастропарез при БП наблюдается редко.
Нарушения мочеиспускания при БП включают императивные позывы и учащенное мочеиспускание, никтурию, неполное опорожнение мочевого пузыря, недержание мочи и др. Наиболее распространена гиперрефлексия детрузора, в то время как его пониженная активность встречается реже. Гиперактивность детрузора проявляется никтурией с или без учащенных позывов в дневное время, а недержание мочи является признаком только поздних стадий БП. Выявлены пародоксальные сокращения мышц антагонистов уретрального сфинктера, коррелирующие с нарушением опорожнения мочевого пузыря в период «выключения».
Наиболее распространенным нарушением половой функции у 2/3 пациентов является эректильная дисфункция. Больные отмечают снижение либидо, затруднения в достижении оргазма, в то время как пациенты с длительным течением заболевания имели увеличение сексуальных фантазий.
Болевой синдром при болезни Паркинсона.
После исключения вторичных причин боли (мышечно-скелетные синдромы, нейропатическая боль) распространенность первичных сенсорных симптомов при БП достигает 40—50%. Сенсорные симптомы описывались пациентами, как покалывание, жжение, похолодание, ощущение жара и боли. Боль может возникать в рамках двигательных флюктуаций, ранней утренней дистонии. Возможна глубокая висцеральная боль, связанная с ретроперитонеальным фиброзом на фоне приема эрготаминовых агонистов. Боль также может быть премоторным симптомом БП. Односторонняя проксимальная спонтанная боль в конечности, особенно на стороне начала и наибольшей выраженности заболевания, является одним из распространенных симптомов БП. Предполагается, что причиной боли при БП является поражение парабрахиального ядра, голубоватого пятна, вторичной соматосенсорной и поясной коры.
Развернутые и поздние стадии болезни Паркинсона.
На развернутой стадии БП к вышеперечисленным клиническим симптомам присоединяются когнитивные и психотические нарушения. Развернутые и поздние стадии характеризуются не только количественным нарастанием, но и качественным изменением симптомов.
Кроме того, на развернутой стадии БП клинически значимыми симптомами могут становиться:
1. Дыхательные нарушения, в т.ч.:
– Гипокинезия и утомляемость дыхательных мышц;
– Дисфункция мышц верхних дыхательных путей;
– Респираторная апраксия;
– Обструктивные или центральные апноэ во сне;
– Нарастание в период «выключения».
2. Сенсорные нарушения, в т.ч.:
– Ощущения покалывания, жжения, зуда, онемения, болей;
– Отсутствие зон гипо- или гиперестезии;
– Нарастание в период «выключения».
3. Хроническая усталость – состояние крайнего утомления, слабости, истощения, упадка физических и психических сил, наступающих в результате выполнения привычной для пациента нагрузки и ограничивающее его функциональную активность.
4. Немоторные флюктуации, в т.ч.:
– Тревога – 49%
– Гипергидроз – 48%
– Дизестезия – 48%
– Усталость – 42%
– Дисфория – 37%
– Кардиалгии – 29%
– Нарушения мочеиспускания – 26%
– Одышка – 10%
– Боль – 18%
5. Моторные флуктуации, в т.ч.:
– Феномен истощения конца дозы, т.е. постепенное ослабление эффекта к концу действия дозы леводопы в виде нарастания симптомов паркинсонизма в утренние часы или к моменту приема следующей дозы;
– Исчезновение или значительное уменьшение симптомов паркинсонизма после приема очередной дозы;
– Цикличность, предсказуемость нарастания и уменьшения симптомов.
– Феномен «включения» – «выключения». Резкий переход от состояния компенсации симптомов к обездвиженности. Нарастает тяжесть периодов «выключения». Сокращается длительность периодов «включения». Ночная и утренняя акинезия.
– Отложенное «включение». Отложенное «включение» – наступление эффекта через 60 и более минут после приема леводопы. Эпизодическое отсутствие эффекта принятой дозы. Частая причина: несоблюдение режима приема по отношению к еде (особенно богатой белками), нарушение перистальтики желудочно-кишечного тракта (ЖКТ), прием леводопы замедленного высвобождения.
– Отсутствие «включения».
– «Йо-йоинг» – непредсказуемость развития периодов «выключения» и «включения». Спонтанно или на фоне случайных причин (например, стресс) внезапное «выключение». Внезапное улучшение крайне редко.
6. Дискинезии, в т.ч.:
– Дискинезии пика дозы. Хореоформный или быстрый дистонический гиперкинез (лицо, шея, туловище, конечности). На развернутых и поздних стадиях сопровождают весь период «включения». Причина: сужение терапевтического окна допамина (снижение порога развития дискинезий).
– Дискинезии плато дозы. Хореоформный или быстрый дистонический гиперкинез (лицо, шея, туловище, конечности). На развернутых и поздних стадиях сопровождают весь период «включения». Причина: сужение терапевтического окна допамина (снижение порога развития дискинезий)
7. Двухфазные дискинезии:
– Дистонии «выключения». Фокальная болезненная дистония, чаще в нижних конечностях, реже генерализованная дистония или акатизия.
Моторные флуктуации и дискинезии:
– определяют тяжесть состояния и качество жизни пациента на развернутых стадиях БП;
– встречаются в подавляющем большинстве случаев развернутых стадий БП (30—95% в зависимости от длительности болезни);
– коррекция моторных флуктуаций и дискинезий – основа лечения пациента на развернутых стадиях БП.
Частота моторных флуктуаций и дискинезий:
2 года от начала лечения леводопой: феномен «истощения конца дозы» более 50%, дискинезии – 46%, «вкл – выкл» – 10%;
5 лет: флуктуации и дискинезии 22% пациентов;
БП до 5 лет: флуктуации – 8%, дискинезии – 4%;
БП более 5 лет – 50%, дискинезии – 28%;
БП более 10 лет – флуктуации 75—85%;
БП 15 лет – дискинезия 94%, истощение дозы – 96%.
Когнитивная дисфункция.
Когнитивные нарушения могут наблюдаться уже на ранних стадиях БП, проявляясь нарушением исполнительных функций и зрительно-пространственного дефицита. До 40% пациентов с БП имеют деменцию, что в 6 раз выше, чем в контрольной группе, у 84% она развивается через 15—18 лет от начала заболевания. Клинические проявления деменции при БП включают брадифрению, нарушения зрительно-пространственного гнозиса, флюктуации внимания, расстройства личности и настроения, галлюцинации и психоз, однако речь и праксис остаются преимущественно сохранными. Деменция связана с ухудшением эффективности дофаминергического ответа и, следовательно, прогноза заболевания. Несмотря на наличие в кортикальных и субкортикальных структурах телец Леви, основной причиной развития когнитивных нарушений является гибель холинергических нейронов в базальном ядре Мейнерта, причем объем гиппокампа при БП и болезни Альцгеймера уменьшен в аналогичной степени.
Психотические нарушения.
Наличие психотических симптомов значительно ухудшает прогноз БП и увеличивает смертность. Клинический спектр психоза при БП включает зрительные иллюзии, галлюцинации, параноидный галлюцинаторный психоз, бред и другие симптомы. Малые или экстракампинные галлюцинации представляют собой феномены «присутствия» и «прохождения», когда у больного возникает ощущение присутствия некоего существа (человек или животное) за спиной в комнате или его прохождения по периферии поля зрения. До 40% пациентов с БП имеют зрительные галлюцинации, которые обычно носят яркий хорошо оформленный характер, слуховые и обонятельные галлюцинации встречаются реже. Вероятной причиной возникновения зрительных галлюцинаций при БП является дегенерация педункулопонтинного ядра, голубоватого пятна и ядер шва, которая также приводит к развитию поведенческого нарушения REMфазы сна. Факторами риска возникновения галлюцинаций являются когнитивные нарушения и прием препаратов L-ДОФА; возраст, длительность заболевания и депрессия не играют значительной роли.
Все классы антипаркинсонических препаратов способны провоцировать галлюцинации и психоз. Провокация появляется предположительно по причине возникновения фрагментации сна, приводящей к ярким сновидениям, галлюцинациям и делирию. Ранние галлюцинации в ответ на назначение дофаминергической терапии при БП коррелировали с развитием когнитивных нарушений и деменции.
Диагностика болезни Паркинсона
Доклиническая диагностика
В настоящее время известно, что для БП характерна продромальная фаза, однако выявление людей с субклиническими проявлениями БП остается сложной задачей. Результаты патологоанатомических исследований свидетельствуют о том, что на момент постановки диагноза в черной субстанции отмечается выраженная потеря нейронов, а в последующие 4 года происходит почти тотальная гибель дофаминовых окончаний в дорсальной области стриатума. Путем экстраполяции этих данных было рассчитано, что патологические процессы в головном мозге начинаются за 5—10 лет до появления первых клинических симптомов и постановки диагноза, поэтому перспективным представляется поиск предикторов БП. Среди возможных предикторов БП выделяют: поведенческое расстройство фазы быстрого сна (ПРФБС), идиопатическую аносмию и моногенные мутации, тесно связанные с БП.
ПРФБС характеризуется отсутствием мышечной атонии во время фазы быстрого сна, из-за чего во сне могут возникать вокализации или сложные двигательные акты. Расстройство, как правило, манифестирует у мужчин старше 50 лет (средний возраст 50—65 лет). ПРФБС тесно связано с БП и другими синуклеинопатиями, такими, как деменция с тельцами Леви и мультисистемная атрофия, и часто впервые выявляется при этих заболеваниях у людей с отсутствием расстройств сна в анамнезе. Кроме того, почти у всех людей с ПРФБС впоследствии развивается одно из трех заболеваний. ПРФБС как изолированное расстройство и как продромальная фаза БП сочетается с объективными и субъективными признаками моторного и немоторного дефицита, включая нарушение баланса равновесия, изменение походки и другими большими и малыми признаками двигательной заторможенности.
Хроническая аносмия или гипосмия может быть обусловленной рядом состояний: врожденных, посттравматических, постинфекционных, идиопатических, или быть связанной с нейродегенерацией. Аносмия – нередкое явление, оно встречается в 20% популяции. Аносмия характерна для большинства пациентов с БП. У родственников лиц с БП, не имеющих нейропсихических или установленных обонятельных расстройств, нарушения обоняния свидетельствуют о повышенном риске развития БП в течение 2 лет. Потеря обоняния ассоциирована с 5-кратным повышением риска БП в течение 4 лет наблюдения, при поправке на возраст и другие факторы, играющие роль в развитии БП (курение сигарет, потребление кофе, запоры).
В исследовании факторов риска БП (The Parkinson At-Risk Study, PARS) проводился поиск признаков продромальной фазы заболевания. Были обследованы 669 взрослых человек старше 50 лет с гипосмией, как основным продромальным признаком БП, и 4330 человек с интактным обонянием. В группе с нарушением обоняния чаще встречались запоры (21% против 16% в группе с интактным обонянием), тревога (в психическом статусе у 19% против 14%, как черта личности у 23% против 17%) и депрессия (19% против 11%). Признаки ПРФБС также были более распространены у людей с гипосмией (12% против 7% или 3% против 1% для непроизвольных движений разной интенсивности). В другом аналогичном исследовании около 700 человек в возрасте 50—85 лет с признаками продрома (нарушение обоняния, депрессия или ПРФБС) осматривались дважды в год. Выраженные различия были отмечены в частоте возникновения запоров (7% в группе аносмии, 22% в группе ПРФБС и 25% в группе депрессии), нарушений сна, отличных от ПРФБС (34%, 65% и 53%, соответственно), зрительно-пространственного восприятия (2,2%, 12% и 14%, соответственно), ортостатической гипотензии (13%, 33% и 25%) и когнитивных нарушения (брадифрения: 24%, 36%, 46%, запоминание слов: 37%, 60%, 53%). Таким образом, наиболее тесные связи с остальными признаками были выявлены для ПРФБС.
Методы исследования обонятельного анализатора.
В Европе с 1995 года cертифицирован Sniffin’ Sticks test (Сниффин Стикс тест, ССТ). Сейчас его используют в Германии, Австрии, Швейцарии, Италии. Тест является многоразовым, портативным, функционирует 6—12 мес. Включает скрининг и экстендид (расширенный) тесты (рис. 9).
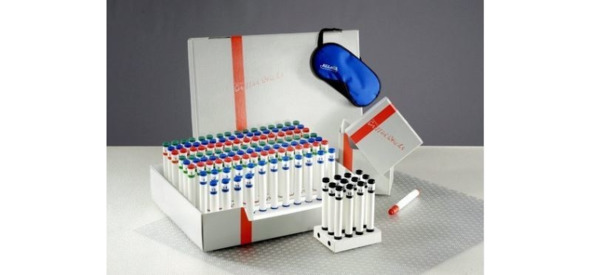
Рис. 9. Комплект для проведения Sniffin’ Sticks test.
ССТ состоит из трех испытаний:
1. Определение порога обоняния, чувствует ли пациент запахи. Порог – это та минимальная концентрация запаха, которую ощущает пациент. В 16 пронумерованных карандашах находится н-бутанол в разных концентрациях от 1 до 16 по убыванию интенсивности запаха. В триплет входит один карандаш с запахом, два без. Тест начинается с того, что испытуемому предлагают определить, чувствует ли он запах в карандаше N1 с самой высокой концентрацией н-бутанола. Затем подносят карандаш N16, 15, 14… и т. д. до правильного определения карандаша с запахом. Карандаши в триплете меняют местами и проводят повторное исследование. Результат считается положительным, когда повторное исследование совпало с предыдущим. Далее проводят то же самое с другой пробиркой с большей интенсивностью запаха и т. д. В тесте должно быть 7 максимальных ответов, по последним 4 из которых выводят среднее значение.
2. Определение дискриминации. Это способность выбрать 2 одинаковых запаха из 3 предлагаемых. Тест состоит из 16 пронумерованных триплетов, каждый карандаш в триплете дается 1 раз. Сумма положительных ответов из 16 является количественным результатом теста.
3. Определение идентификации. Способность определить запах по предложенным 4 наименованиям. Пациенту подносят по 1 карандашу из 16 для вдыхания запаха, перед глазами он имеет 4 названия запахов, один из которых должен выбрать (рис. 10). Результат складывается из суммы положительных ответов на 16 предъявленных запахов.
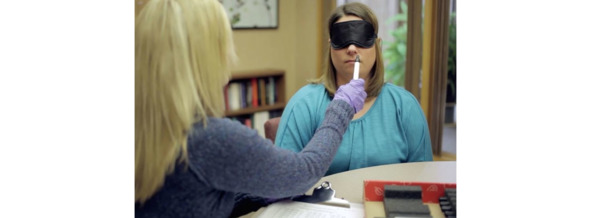
Рис. 10. Процедура проведения исследования обонятельного анализатора.
Smell identification test или Пенсильванский тест разработан в 1984 году в Пенсильванском университете (США). Тест Пенсильванского университета позволяет выявить большинство нарушений обоняния и исключить симуляцию расстройств обоняния. Тест содержит 40 образцов различных запахов с четырьмя вариантами ответа каждый. Образцы запаха представляют собой пластинки микрогранул, нанесенные на плотную бумагу (рис. 11). Тест снабжен точным количественным расчетом показателей, свидетельствующих о развитии заболевания. Достоинством теста являются: надежность, низкая себестоимость, простота использования, возможность тестирования в любых условиях, даже самотестирования в домашних и полевых условиях. Тест отличает очень высокая воспроизводимость результатов (r=0,90—0,92).

Рис. 11. Smell identification test или Пенсильванский тест.
Методы исследования нарушений почерка.
Современные технологии позволяют оценивать параметры почерка по объективным показателям. Специалистами из Университета Хайфы Сарой Розенблюм и профессором Тамаром Вейссом с этой целью был разработан прибор под названием «ComPET». Он состоит из беспроводной электронной ручки и бумаги, наложенной на электронную табличку, на которой человек пишет. Система состоит из двух блоков: для сбора и для анализа данных. Прибор оценивает время контакта ручки с бумагой и время, когда ручка зависает в воздухе, скорость и ускорение, размер букв и промежутки между буквами, степень давления ручки на бумагу и т. д. Специальный софт проводит графический компьютерный анализ. К его разработке были привлечены специалисты-почерковеды. Образцы почерка сохраняются в оцифрованном виде, что позволяет сравнивать их в разных группах и через разные промежутки времени. В случае БП появляется возможность следить за развитием и прогрессированием заболевания.
В эксперименте с участием 40 испытуемых прибор «ComPET» по анализу почерка выявил БП на ранней стадии с точностью 95%. Ранее с помощью этой же методики ученые из Университета Хайфы выявляли детей с синдромом гиперактивности с нарушением внимания, почерк которых имеет характерные особенности. Кроме того, такую систему можно использовать и для коррекции нарушений почерка, в этом случае она работает по принципу биологической обратной связи.
Диагностика на ранних и поздних стадиях болезни Паркинсона
Анамнез, жалобы и клинические проявления.
Диагностические критерии.
Жалобы:
· тремор (мелкое дрожание конечностей, головы) в конечностях, голове. Обычно возникает в покое, уменьшается при попытке двигать конечностями;
· скованность в мышцах – усиливается при повторных движениях (каждое движение выполняется все сложнее);
· нарушение походки (ходьба мелкими шаркающими шажками); · частые падения (возникают из-за развившейся неустойчивости пациента);
· замедленность движений;
· бедность мимики (отсутствие мимики, лицо практически не выражает эмоций);
· ухудшение памяти, мышления;
· эмоциональные нарушения: склонность к ворчливости, подавленное настроение;
· повышенное слюноотделение изо рта.
Анамнез:
· необходимо уточнить в каком возрасте началось заболевание, какие симптомы были его первым проявлением;
· необходимо уточнить, как началось заболевание (постепенно (незаметно) /внезапно, в связи с какими-либо факторами);
· обратить внимание на наличие когнитивных нарушений, депрессии, галлюцинаций;
· выяснить наличие в семейном анамнезе БП/других нейродегенеративных заболеваний (либо их отдельных симптомов, например, тремора) у родственников, наличие в анамнезе повторных травм головы, профессионального/бытового контакта с токсичными веществами;
· в отношении принимаемых в настоящее время лекарственных средств, уточнить наличие сопутствующих заболеваний.
Физикальное обследование.
Неврологический статус:
· гипокинезия (акинезия);
· ригидность;
· тремор в покое, представляющий ритмическое дрожание II, III и противопоставленного им I пальца кисти с частотой 4—6 Гц, напоминающий скатывание пальцами хлебного шарика (по типу «катания пилюль»/«счёта монет»). В начале заболевания тремор односторонний/асимметричный, усиливается на холоде, при эмоциональном напряжении и усталости, ходьбе, движениях в контралатеральной руке. При движении конечности тремор уменьшается/исчезает, во время сна отсутствует. По мере прогрессирования становится двусторонним, присоединяется дрожание стоп, челюсти, языка, век. Редко возможен дебют с асимметричного, одностороннего тремор покоя стоп;
· вегетативные расстройства;
· аффективные нарушения;
· когнитивные дисфункции;
· психотические нарушения.
Гипокинезия:
· замедленностью движений;
· нарушением инициации;
· снижением скорости и амплитуды повторяемых движений;
· гипомимия;
· редкое мигание;
· замедленная речь (брадилалия);
· гипофоничная и монотонная речь;
· дисфагия с затруднением глотания слюны;
· утрата содружественных движений (ахейрокинез);
· шаркающая, короткими шагами походка;
· мелкий почерк (микрография);
· затруднения при поворотах в постели; · замедленность в повседневной активности.
Ригидность:
· скованность/чувство стягивания в шее, нижней части спины, в мышцах руки/ноги (в начале заболевания ригидность носит асимметричный, односторонний характер усиливается при отвлечении внимания/движениях в контралатеральной конечности);
· мышечный тонус вязкий, пластический, монотонный, усиливается при каждом повторном пассивном движении в процессе проверки (феномен «восковой куклы», феномен «свинцовой трубы») толчкообразно меняется (феномен «зубчатого колеса»).
Постуральная неустойчивость:
· нарушение способности удерживать равновесие тела/ходьбе; Нарушение способности удерживать равновесие тела/ходьбе предрасполагает пациента к частым падениям чаще вперед, реже назад при ходьбе, поворотах на месте, вставании с кресла или постели. Для выявления позных нарушений проводят толчковую пробу на пропульсию/ретропульсию. В ранних стадиях БП затрудняются преимущественно тонкие движения в конечностях. Для выявления лёгкой степени гипокинезии можно попросить больного побарабанить пальцами по столу, постучать стопой о пол, быстро сжимать и разжимать кулаки, пронировать и супинировать предплечья. Следует обращать внимание на асимметрию движений, на феномен «истощаемости» (декремент) – замедление движения при его повторении с уменьшением амплитуды.