
Реабилитация при болезни Паркинсона
Тремор при БП.
Классическим вариантом тремора при БП является тремор покоя, развивающийся чаще в дистальном отделе рук, усиливающийся при движениях другими конечностями и при ходьбе, характерен паттерн по типу «скатывание пилюль» или «счет монет», тремор носит асимметричный характер, у части больных постуральный тремор или кинетический тремор, тремор возобновляется при удержании позы
Выделяют следующие виды тремора при БП:
1. Тремор покоя 3-6-Гц и постурально-кинетический той же частоты;
2. Тремор покоя 3-6-Гц и постурально-кинетический высокой частоты (до 9 Гц);
3. Изолированный постурально-кинетический высокой частоты (до 9 Гц);
4. Изолированный тремор покоя.
Постуральные нарушения при БП.
Постуральная неустойчивость – это неспособность удерживать равновесие при изменении положения тела или ходьбе. У пациентов с БП смещение центра тяжести при изменении позы не вызывает компенсаторных движений (ходьба, вставание, повороты на одном месте, ходьба назад, наклон вперед). Для определения постуральной неустойчивости рекомендуется проводить толчковую пробу или пробу Тевенара. Данная проба предложена французским неврологом A. Thevenard (1898—1959). Проводится проба следующим образом: стоящего больного выводят из состояния равновесия, подталкивая вперёд или назад, врач обычно становится за спиной больного и рывком за плечи тянет его на себя. Больные с постуральной неустойчивостью при этом падают или, пытаясь всё же удержать равновесие, делают несколько мелких шажков вперёд (пропульсия) или назад (ретропульсия). Нормой является – не более 2-х шагов для удержания равновесия. К постуральным нарушениям при БП также будет относится: изменения позы, преобладание тонуса в сгибательной мускулатуре – поза «просителя» (сгибательная поза), камптокармия (camptocormia; греч. campto – гнуть, сгибать и kormos – туловище) – выраженный наклон туловища вперед, антероколлис, наклон туловища вбок, сколиоз (симптом Пизанской башни).
Для описания согнутого позвоночника у пациента с БП термин «камптокормия» впервые использовали в 1999 г.. В ряде исследований описаны показатели распространенности камптокормии при БП в пределах от 3 до 17,6% (Таб. 7). Такой широкий диапазон, вероятно, обусловлен различными пороговыми значениями, используемыми для диагностики камптокормии, а также вследствие отсутствия точного клинического определения и различий изучаемых популяций. Результаты эпидемиологических исследований указывают на то, что распространенность камптокормии может быть выше у азиатов, что может отражать генетические различия в строении скелета между различными этническими группами. Большинство исследователей сообщают о наличии положительной связи между камптокормией и тяжестью заболевания. У пациентов с камптокормией наблюдают тенденцию к более тяжелому течению паркинсонизма, чем у лиц без этой деформации. Камптокормию также чаще выявляют у пациентов более старшего возраста. В среднем камптокормия формируется спустя 7—8 лет после начала развития паркинсонизма.
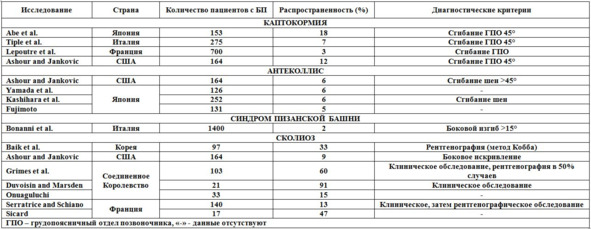
Таб. 7. Исследования распространенности постуральных деформаций у пациентов с паркинсонизмом.
Диагностика камптокормии при паркинсонизме основана только на результатах клинического обследования, поскольку исследование этиологических причин деформации затруднено вследствие недостатка знаний в этой области. Тем не менее некоторые специфические признаки могут указывать на альтернативный диагноз. Например, слабость при выпрямлении туловища свидетельствует о наличии сопутствующей миопатии или поражении клеток переднего рога, что должно инициировать дальнейшее обследование в этом направлении. Постоянная деформация, которая сохраняется даже в положении лежа на спине, указывает на наличие костно-суставных изменений, которые могут быть как ее причиной (например, перелом позвоночника, анкилозирующий спондилит) или развиваться вторично по отношению к деформации (например, приобретенная дегенеративная спондилоартропатия). Список диагнозов, вероятность которых следует рассматривать, а также дополнительные исследования, к подбору которых необходимо подходить индивидуально, представлен на рис. 8.
Под антеколлисом при паркинсонизме подразумевают сгибание вперед головы и шеи. Если антеколлис легко выражен, его можно рассматривать, как элемент сутулой позы при БП, но у некоторых пациентов отмечают так называемый непропорциональный антеколлис: шея свисает вперед больше, чем ожидается, по сравнению с согнутым положением туловища и конечностей. Термин «синдром свисающей головы» (dropped head syndrome) иногда используют для описания выраженного изгиба шеи, но гораздо более часто он относится к таким нейромышечным заболеваниям, как миастения (myasthenia gravis), полимиозит и болезнь двигательного нейрона (БДН), при которых данное состояние связано со слабостью мышц-разгибателей шеи (что непосредственно приводит к свисанию головы вперед).
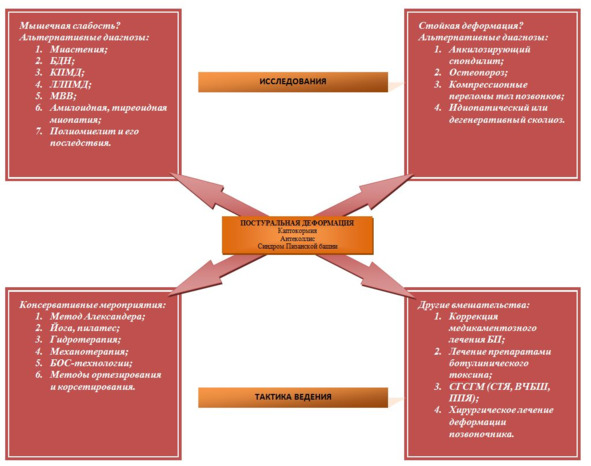
Рис. 8. Дифференциальная диагностика, исследования и варианты лечения постуральных деформаций при болезни Паркинсона БДН – болезнь двигательного нейрона. БОС – биологическая обратная связь. КПМД – конечностно-поясная мышечная дистрофия. ЛЛПМД – лице-лопаточно-лицевая мышечная дистрофия. МВВ – миозит (миопатия) с внутриклеточными включениями. АХР – ацетилхолиновые рецепторы. АТ – антитела. КК – креатинкиназа. ЭМГ – электромиография. СГСГМ – стимуляция глубоких структур головного мозга. СТЯ – субталамическое ядро. ВЧБШ – внутренняя часть бледного шара. ППЯ – педункулопонтинное ядро.
Антеколлис лишь недавно стали рассматривать как проявление паркинсонизма. Его считают сравнительно распространенным проявлением множественной системной атрофии (MCA), при которой антеколлис относительно постоянный, в отличие от идиопатической спастической кривошеи. В ретроспективном исследовании Ashour и Jankovic указывают на высокую распространенность этой деформации (42,1%) у пациентов с MCA, тогда как средний показатель распространенности при БП гораздо меньше – 5,8%. При изучении серии клинических случаев (15 больных с болезнью Паркинсона) антеколлис чаще выявляли у женщин, а также у пациентов, у которых выраженными признаками паркинсонизма были ригидность и акинезия. Как и при других постуральных деформациях, этническое происхождение исследуемой популяции влияет на распространенность – больше всего случаев антеколлиса зарегистрировано в Японии.
Антеколлис может развиваться подостро в течение недель или месяцев. Он может возникать до появления других двигательных проявлений БП, но чаще развивается через несколько лет после начала заболевания. Пациенты могут жаловаться на боль по задней поверхности шеи или на проблемы, возникающие в связи со сгибанием шеи (затруднение глотания, избыточное слюнотечение или ограничение поля зрения). Антеколлис при БП часто ассоциируется со значительным повышением тонуса аксиальных мышц, хотя у некоторых пациентов еще остается возможность пассивного разгибания до нормального положения. У других пациентов антеколлис может перейти в постоянную деформацию, даже спустя короткое время после начала развития.
Дополнительные диагностические исследования при антеколлисе необходимо назначать на основании результатов физикального обследования. По мере увеличения давности существования деформации антеколлис часто ассоциируется с ограничением диапазона движений, но в тех случаях, когда существенное ограничение движений шеи возникает подостро или интенсивность боли не соответствует таковой при антеколлисе, необходимо проведение визуализации для исключения патологии шейного отдела позвоночника. При выявлении антеколлиса наиболее распространенной альтернативой БП является МСА, при которой антеколлис – частое явление. В недавних сообщениях также обращают внимание на возможное влияние медикаментозного лечения на положение шеи. Антеколлис может представлять собой явление, развивающееся в отсутствие приема препаратов, или возникающее при повышении дозы дофаминергических лекарственных средств, так же, как дискинезии, поэтому необходимо исследовать изменения выраженности антеколлиса и взаимосвязь этих изменений с периодами приема и отмены лекарственных средств. Существует несколько сообщений о случаях, когда развитие антеколлиса могло быть индуцировано приемом агонистов дофамина (7 пациентов получали прамипексол, 5 – каберголин, 2 – перголид; в 2 случаях лекарственное средство не было идентифицировано) или применением амантадина. Поэтому при наличии тесной взаимосвязи времени начала приема указанных препаратов и развития антеколлиса необходимо прервать прием этих лекарственных средств в качестве диагностической пробы, хотя следует учитывать, что антеколлис не обязательно обратим, особенно в тех случаях, когда до отмены препарата лечение проводили в течение длительного времени.
Наличие у пациента мышечной слабости при исследовании остаточного разгибания шеи должно побуждать к проведению обследования для выявления нейромышечной патологии. Если пациенты сообщают о двоении в глазах или о симптомах, указывающих на повышенную утомляемость, необходимо рассмотреть вероятность наличия миастении. Опубликовано небольшое количество сообщений, в которых описано коморбидное течение БП и миастении у пациентов с антеколлисом. Мышечная слабость при разгибании шеи также может быть проявлением болезни двигательного нейрона. У пациентов с БП и антеколлисом, но без слабости, отклонения от нормы могут быть выявлены при проведении электромиографии (ЭМГ) и биопсии мышц, но данные исследования часто неспецифичны и не имеют диагностической ценности для определения того, являются они причиной развития антеколлиса или его следствием.
Синдром Пизанской башни (СПБ) – это выраженный боковой изгиб туловища, который обычно не является фиксированным (например, исчезает в положении лежа). Впервые СПБ был описан, как дистония туловища, или плеврототонус (плеврототонус (pleurothotonus) – разновидность тетанических судорог, при которых происходит отклонение туловища вбок, в отличие от отклонения вперед (эмпростотонус), назад (опистотонус) или застывания тела в выпрямленном положении (ортотонус)), встречающаяся в виде побочного эффекта антипсихотического лечения. Позднее СПБ был описан при БП. Помимо этого он был описан у пациентов с болезнью Альцгеймера, которые получали ингибиторы холинэстеразы. СПБ встречается также как идиопатический феномен и может предшествовать развитию сколиоза при БП.
Диагностических критериев СПБ не существует, хотя Bonanni et аl. предложили следующие критерии определения боковой аксиальной дистонии: боковое сгибание туловища более 15°, которое нарастает во время ходьбы и нивелируется в положении лежа на спине при отсутствии каких-либо механических ограничений для движений туловища (например, дегенеративные заболевания позвоночника), а также продолженная активность на ЭМГ околопозвоночных мышц поясничного отдела позвоночника на стороне изгиба. Некоторые специалисты считают, что СПБ может быть диагностирован при выраженном (не менее 10°) боковом изгибе, который полностью исчезает при пассивной мобилизации или в положении лежа на спине. Сгибание в одну сторону очень часто встречается в поздних стадиях БП. Сколиоз при БП более распространен, чем в общей популяции пожилых людей, его частота находится в диапазоне от 8,4 до 90,5% при паркинсонизме и от 8,5 до 60% при БП.
У большинства пациентов в ранних стадиях не наблюдают какого-либо бокового изгиба позвоночника. СПБ может развиваться длительно (вначале без явных симптомов и затем с постепенным ухудшением) или с подострым началом, за которым следует быстрое ухудшение в течение нескольких месяцев. Сначала становится заметна тенденция к наклону в одну сторону при сидении пациента на стуле, а несколько позднее – боковое сгибание во время ходьбы. При прогрессировании деформации у пациентов могут появляться болевой синдром, диспноэ или неустойчивость, которая приводит к падениям.
Во время обследования пациент сидит, стоит или идет непроизвольно наклоняясь постоянно в одну сторону. Может быть нарушено восприятие вертикального положения, и при просьбе выпрямиться пациенты полагают, что они уже сделали это; следовательно, активное движение для приведения пациента в положение по средней линии может вызывать ощущение потери равновесия.
Существуют разногласия по поводу того, направлен ли боковой изгиб туловища у пациентов (как при СПБ, так и при сколиозе) в ту сторону, где преобладает выраженность характерных для паркинсонизма симптомов, или в противоположную. Большинство исследователей пришли к выводу, что у пациентов существует тенденция к наклону в сторону, противоположную стороне, и только некоторые авторы не выявили связи между направлением изгиба и латерализацией БП.
Диагноз СПБ можно установить клинически на основании наличия бокового изгиба туловища, который может быть скорректирован при помощи пассивной мобилизации или в положении лежа на спине. Для диагностики и количественной оценки степени сколиоза необходимо проведение визуализационного исследования позвоночника с определением угла Кобба. Как и в случае антеколлиса, есть сообщения, что развитие СПБ может быть побочным эффектом приема лекарственных средств. Первоначально считали, что он развивается вторично при приеме блокаторов дофамина, но в более поздних работах отмечено, что развитие СПБ находится в тесной временной связи с изменениями в дофаминергической терапии (как введение нового лекарственного средства, так и повышение дозы препарата, который уже принимает пациент). Обобщенные критерии для определения варианта постуральной деформации представлены в таблице №8.

Таб. 8. Критерии определения варианта постуральной деформации.
Дебют болезни Паркинсона.
При дебюте заболевания клинические проявления имеют следующие особенности:
1. Проявления заболевания, как правило одностороннего характера;
2. Чаще симптомы заболевания развиваются в верхней конечности.
3. Классическими симптомами дебюта заболевания являются: скованность, замедленность, в т.ч. изменение почерка, «подтягивание» руки при ходьбе, неловкость при выполнении мелких движений.
4. Первым симптомом может стать односторонняя боль в плечевом суставе, а также боли в шейном и поясничном отделах позвоночника;
5. Чувство слабости и онемения в руке или ноге;
6. «Приволакивание» нижней конечности с одной стороны при ходьбе;
7. Замедленность ходьбы (по сравнению с исходным уровнем);
8. Затруднение при одевании (рукав одежды или обувь с одной стороны).
Ранние стадии болезни Паркинсона.
На ранних стадиях БП основными клиническими проявлениями становятся: нарушения обоняния, вегетативные нарушения (дисфункция желудочно-кишечного тракта (ЖКТ), мочеиспускания, половой функции, потоотделения, постуральная гипотензия, себорея), аффективные нарушения, нарушения сна, чувствительные нарушения.
Обонятельные нарушения.
Уже на самых ранних стадиях БП характеризуется развитием обонятельного дефицита, при этом обонятельные нарушения могут развиваться за несколько лет до появления двигательных расстройств. Первые публикации по обонятельному дефициту при БП появились в 1975 году, когда было описано повышение порога обоняния у 22 пациентов с клиническим диагнозом БП при вдыхании банан амилацетата. Последующие исследования подтвердили наличие более чем у 50% пациентов с БП повышенного порога при вдыхании амилацетата. В целом, среди пациентов с БП обонятельные нарушения выявляются в 70—90% случаев, а по данным Lotsch с соавт. (2008) – даже в 99% случаев. При этом обонятельные нарушения могут не ощущаться самим пациентом, поэтому для их выявления принципиальным является проведение специального тестирования. После возникновения «субклинических» обонятельных нарушений через 2—7 лет у пациентов развиваются моторные симптомы БП. Показано, что среди неврологически здоровых лиц с выявленным обонятельным дефицитом, как минимум у 10—13% в будущем развивается БП. Лица со сниженной функцией обоняния имеют более высокий риск БП, либо выявления телец Леви на аутопсии: в популяционном исследовании PRIРS (Prospective validation of Risk factors for the development of Parkinson Syndrome) относительный риск развития БП среди лиц с гипосмией за три года составил 3,9%, а по данным проспективного исследования Гонолулу, риск развития БП у неврологически здоровых людей с гипосмией возрастает в 5 раз. У ближайших родственников больных БП гипосмия повышает риск развития заболевания в ближайшие 2 года на 10—20%. Показано, что снижение обоняния характерно для БП и болезни диффузных телец Леви, но не для других паркинсонических синдромов, таких как прогрессирующий надъядерный паралич и другие.
Точность оценки степени и характера гипосмии значительно повышается при использовании специальных тестов – UPSIT (Пенсильванский тест), Sniffin’ Sticks и др.
Как уже сказано ранее, моторные проявления при БП начинаются при гибели не менее 60% дофаминэргических нигральных нейронов, тогда как для обонятельной дисфункции подобные корреляции установить сложнее. В целом, не выявлено зависимости гипосмии от стадии болезни: так, на развернутых стадиях БП количественная оценка дефицита обоняния, по данным многих авторов, не коррелировала с возрастом, тяжестью состояния (включая уровень моторных и когнитивных нарушений), длительностью заболевания и проводимой терапией. Однако есть и другая точка зрения: используя Sniffin’ Sticksтест, Daum et al. (2000) нашли отрицательную корреляцию между уровнем дискриминации запахов и тяжестью БП. Аналогичным образом, Tissingh et al. (2001) выявили отрицательную корреляцию между обонятельной дискриминацией и стадией заболевания по шкалам UPDRS и Hoehn-Jahr. Hawkes с соавт. (1993) с помощью UPSIT-теста обнаружили возрастную линейную регрессию обоняния при БП, что свидетельствует об объединенном эффекте понижения обоняния как по возрасту, так и по развитию БП. Эти данные показывают сложность интерпретации гипосмии у пожилых пациентов с БП. Действительно, способность идентификации запахов начинает уменьшаться уже с 36 лет, а между 56 и 80 годами 50% лиц имеют тот или иной дефицит обоняния. Deeb et al. (2006) сообщили о существенной корреляции между суммой баллов в UPSIT-тесте и моторными нарушениями уже в ранних стадиях БП. Это наблюдение, наряду со многими другими, подчеркивает ассоциацию обонятельных и моторных нарушений при БП. Согласно данным Sniffin’ Sticks-теста, у пациентов с БП ольфакторная дисфункция проявляется в виде ухудшения всех трех показателей, но наиболее значимым является нарушение идентификации запахов, при этом, с удлинением срока идентификация запахов остается неизменной, а вот значения дискриминации запахов ухудшаются. В отличие от этих данных, Lotsch с соавт. (2008) при проведении Sniffin’ Sticks-теста сделали вывод, что наиболее показательна для БП сумма всех трех изучаемых параметров в целом, менее значим пороговый тест, еще менее значимы идентификация и дискриминация по отдельности. При исследовании гипосмии в качестве биомаркера БП интересны работы, оценивающие прогностический потенциал ольфакторных нарушений непосредственно для самого течения БП. В своей работе Stephenson с соавт. (2010) показали связь между выраженностью гипосмии и повышенным риском определенных осложнений БП, а именно, когнитивных нарушений и зрительных галлюцинаций. Для этого с помощью UPSIT-теста были обследованы 100 пациентов с БП, длительность от начала симптомов БП до тестирования обоняния составила в среднем 3,6 лет. При повторном обследовании спустя 6,8±4,6 лет оказалось, что у 37% больных развились зрительные галлюцинации, у 38% – когнитивные нарушения, у 66% – дискинезии, а у 65% появились падения. Сопоставление этих осложнений с данными UPSIT показало, что выраженная гипосмия является прогностически неблагоприятной в отношении развития когнитивных нарушений и зрительных галлюцинаций. При этом гипосмия не является предиктором моторных осложнений БП. Был сделан вывод, что нарушения обоняния отражают, прежде всего, экстранигральную патологию, а не стриатонигральную дисфункцию. Это согласуется с постадийным развитием БП, в котором обонятельные луковицы представляют собой промежуточный этап на пути распространения телец Леви к коре больших полушарий. Сходные данные получены Baba et al. (2012): авторы показали, что выраженная гипосмия – предиктор развития деменции при БП по результатам 3-х-летнего наблюдения. Таким образом, поскольку гипосмия может быть непосредственным, прогностически важным маркером инвалидизирующих нейропсихиатрических осложнений, ее диагностика имеет значение для выстраивания особой стратегии лечения БП.
Снижение обоняния при БП объясняется, в первую очередь, патоморфологическими исследованиями, в которых показано, что обонятельные луковицы поражаются на начальных стадиях еще до вовлечения черной субстанции в процесс нейродегенерации. Обонятельная луковица содержит около 20 медиаторов, включая дофамин. И если моторный дефицит при БП связан с дофаминэргической денервацией стриатума, то в обонятельной луковице при БП (во всяком случае, в дебюте заболевания) значимого дефицита дофамина нет. Иными словами, у пациентов имеет место функциональная аносмия, которая подтверждена исследованиями Herting et al. (2008). При проведении повторных обонятельных тестов через 3—6 лет обнаружилось, что ольфакторная функция нестабильна, а ее изменения имеют сложный нелинейный характер. Объяснение обонятельной дисфункции при отсутствии дефицита дофамина в обонятельной луковице найдено Huismann et al (2004). Авторы обнаружили увеличение дофаминэргических нейронов в луковице у больных БП, что вызывает изменения в расшифровке ольфакторной информации. В этом случае ольфакторный дефицит может быть связан с увеличением ингибирования дофаминэргических нейронов в луковице, что способствует гипосмии или функциональной аносмии.
Помимо нарушения дофаминергической медиаторной системы, в генезе обонятельных нарушений при БП имеет значение изменение холинергической активности в гиппокампе, миндалине и неокортексе. В исследовании Bohnen et al. (2010) с помощью обонятельного теста UPSIT и позитронно-эмиссионной томографии (ПЭТ) с [11C] метил-4-пиперидинил пропионатом выявлена была достоверная позитивная связь между активностью холинэстеразы в лимбической системе и уровнем нарушения обоняния. При этом снижение обоняния по шкале UPSIT больше коррелировало с уровнем активности холинэстеразы в лимбической системе, чем с активностью моноаминергической иннервации в стриатуме. Поскольку на сегодня имеется уже достаточно данных о наличии обонятельных нарушений в премоторной стадии БП, последние исследования обоняния при нейродегенеративных заболеваниях направлены на отработку алгоритма для дифференциальной диагностики и раннего выявления так называемой группы риска – лиц, имеющих высокую предрасположенность к развитию БП. Так, например, обонятельное тестирование входит в скрининговые популяционные программы PARS (Parkinson Associated Risk Syndrome), PRIPS (Prospective validation of Risk factors for the development of Parkinson Syndrome) и др. Работы группы S. Boesveldt показывают, что расширенные обонятельные тесты не увеличивают диагностическую точность при БП по сравнению с одиночными тестами. Очевидно, идентификационного теста из 16 предметов, входящего в Sniffin’ Sticks-тест, достаточно, чтобы уловить ольфакторные нарушения при его использовании.
Нарушения психоэмоциональной сферы.
Депрессия – наиболее распространенный симптом при БП. До 45% всех пациентов с БП имеют клинически значимую депрессию. F. Nilsson и соавт. установили, что пациенты с депрессией имеют больший риск развития БП, чем пациенты с остеоартритом и сахарным диабетом. Другое ретроспективное исследование выявило, что прижизненный диагноз депрессии до постановки диагноза БП встречался более чем в 2 раза чаще при сравнении с контрольной группой. Выявление депрессии имеет важное значение, так как она является наиболее значимым фактором, влияющим на качество жизни пациентов с БП. Выявление депрессии при БП осложнено тем, что клиническая картина может включать, как ранние когнитивные нарушения, так и акинетическую симптоматику паркинсонизма, например гипомимию, брадифрению, апатию и др. В патогенезе депрессии играет роль дисфункция дофамин-, серотонин- и норадренергических путей лимбической системы.
Тревожные расстройства также широко распространены при БП и могут быть ее преклиническим фактором риска. По данным различных исследований, до 40% пациентов с БП имеют различные панические расстройства. Спектр тревожных расстройств при БП включает панические атаки, простые и социальные фобии, агорафобию, генерализованные тревожные и недифференцированные тревожные расстройства, фобические, а также обсессивно-компульсивное нарушения. Тревога может быть дофаминзависимым явлением, являясь частью эпизодов «конца дозы» (периоды ухудшения симптомов в конце действия дозы дофаминергического препарата), часто в виде панических атак. В таких случаях она отвечает на коррекцию дофаминергической терапии, направленной на предотвращение подобных эпизодов. Тревога, ассоциированная с депрессией, в некоторых случаях может отвечать на дофаминергическое лечение, но у части пациентов требует специальной коррекции.