
Внутренние болезни. Том 1
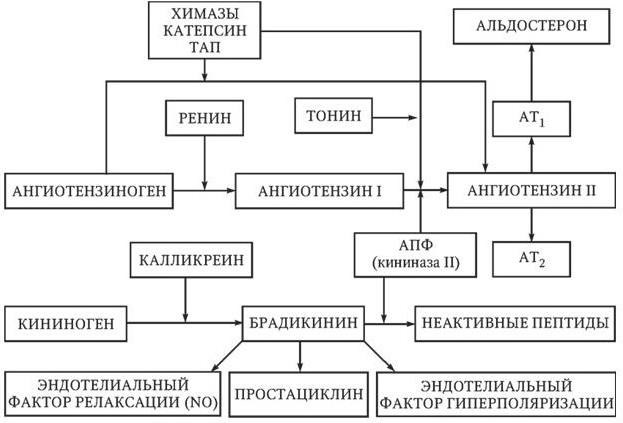
Рис. 1.4. Схема ренин-ангиотензин-альдостероновой системы
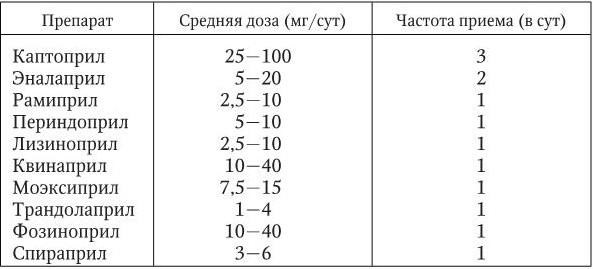
Препараты этого класса рекомендуются больным, у которых АГ сочетается с гипертрофией левого желудочка, микроальбуминурией, протеинурией и нарушением функции почек, пациентам с сахарным диабетом, хронической СН и пароксизмальной мерцательной аритмией. Абсолютными противопоказаниями к применению ингибиторов АПФ являются беременность, выраженная гиперкалиемия, двусторонний стеноз почечных артерий (или стеноз артерии единственной функционирующей почки), анамнестические сведения об ангионевротическом отеке, развившемся на фоне лечения препаратами этого класса. С большой осторожностью ингибиторы АПФ следует применять в лечении пациентов с аортальным стенозом и обструктивной формой гипертрофической кардиомиопатии. Средние дозы и кратность приема наиболее широко применяемых в клинической практике ингибиторов АПФ представлены в табл. 1.13.
Таблица 1.13
Средние дозы и частота приема ингибиторов АПФ, наиболее широко применяемых для лечения больных АГ
Классовыми нежелательными эффектами ингибиторов АПФ являются сухой кашель, обусловленный накоплением брадикинина, и ангионевротический отек. Сухой кашель на фоне приема ингибиторов АПФ отмечается у 3 – 7 % больных европеоидной расы, чаще – у женщин и курильщиков. Частота развития ангионевротического отека не превышает 1 %. Применение ингибиторов АПФ может вызвать развитие почечной недостаточности и гиперкалиемию, поэтому у пациентов с нарушением функции почек в начале лечения необходимо контролировать содержание креатинина и калия в крови. У пациентов, принимающих диуретики, нитраты, другие антигипертензивные препараты, существует риск развития гипотонии после первого приема ингибитора АПФ. Во избежание гипотонии первой дозы рекомендуется отменять диуретики за сутки до приема ингибитора АПФ и начинать лечение с низких доз препарата. В процессе лечения больных ГБ ингибиторами АПФ возможно постепенное ослабление их эффектов в связи с активацией не-АПФ-зависимых путей образования ангиотензина II (см. рис. 1.4).
Блокаторы рецепторов ангиотензина II, так же как и ингибиторы АПФ, снижают активность ренин-ангиотензин-альдостероновой системы и поэтому имеют сходные показания к применению. Основной механизм антигипертензивного действия препаратов этого класса связан с селективным подавлением эффектов ангиотензина II, опосредуемых рецепторами 1-го типа. Дополнительный механизм их гипотензивного эффекта обусловлен усилением воздействия ангиотензина II на специфические рецепторы 2-го типа, активация которых вызывает вазодилатацию, усиление диуреза и натрийуреза (см. рис. 1.4). Препараты этого класса по сравнению с ингибиторами АПФ обеспечивают более полную блокаду ренин-ангиотензин-альдостероновой системы, так как делают рецепторы 1-го типа недоступными для ангиотензина II вне зависимости от пути его образования. Абсолютными противопоказаниями к применению блокаторов рецепторов ангиотензина II являются беременность, гиперкалиемия и двусторонний стеноз почечных артерий.
Поддерживающие дозы блокаторов рецепторов ангиотензина II, наиболее широко применяемых в клинической практике, представлены в табл. 1.14. Все препараты предназначены для приема один раз в сутки.
Таблица 1.14
Средние дозы блокаторов рецепторов ангиотензина II, наиболее широко применяемых для лечения больных АГ

Блокаторы рецепторов ангиотензина II хорошо переносятся. Не воздействуя на АПФ, а соответственно, и на калликреин-кининовую систему, препараты этого класса в меньшей степени, чем ингибиторы АПФ, влияют на функцию эндотелия, но в то же время не вызывают сухого кашля. В начале терапии возможно обратимое ухудшение функции почек.
β-адреноблокаторы вызывают снижение АД за счет ослабления влияния симпатической нервной системы на органы и ткани. Под воздействием β-адреноблокаторов происходит центральное ослабление симпатического тонуса, подавляется высвобождение ренина, снижается сократимость миокарда, уменьшаются частота сердечных сокращений (ЧСС) и сердечный выброс. В терапии АГ применяются неселективные и селективные β-адреноблокаторы. В связи с тем что неселективные β-адреноблокаторы при длительном применении чаще вызывают нежелательные явления (негативные изменения липидного спектра крови, бронхоспазм, ухудшение микроциркуляции и др.), в клинической практике предпочтение отдается селективным препаратам (метопролол, бисопролол, бетаксолол, небиволол).
β-адреноблокаторы предпочтительны для лечения больных, у которых АГ сочетается с ИБС и хронической СН, а также пациентов с тахиаритмиями. Абсолютными противопоказаниями к применению β-адреноблокаторов являются атриовентрикулярная (АВ) блокада II – III степени и бронхиальная астма. Препараты этого класса следует весьма осторожно применять в лечении пациентов со склонностью к брадикардии, хронической обструктивной болезнью легких, нарушением толерантности к глюкозе, болезнью Рейно, облитерирующим атеросклерозом сосудов нижних конечностей, язвенной болезнью в период обострения.
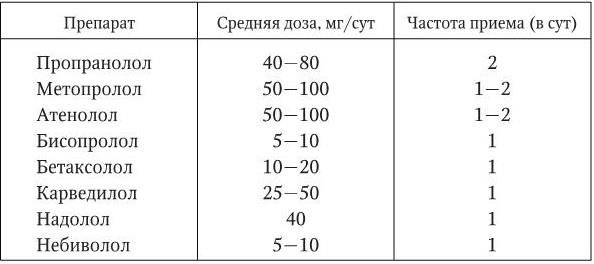
В табл. 1.15 приведены средние дозы и кратность приема β-адреноблокаторов, наиболее широко применяемых в клинической практике.
Таблица 1.15
Средние дозы и частота приема β-адреноблокаторов, наиболее широко применяемых для лечения больных АГ
На фоне терапии β-адреноблокаторами возможно развитие брадикардии, замедление синоаурикулярной и АВ-проводимости, усиление бронхоспазма, нарушение метаболизма глюкозы, а также ряд нежелательных центральных эффектов, обусловленных проникновением препаратов через гематоэнцефалический барьер: слабость, утомляемость, депрессия, кошмарные сновидения, ухудшение памяти.
Блокаторы медленных кальциевых каналов или антагонисты кальция — эффективные антигипертензивные средства. Для лечения больных АГ применяются главным образом пролонгированные антагонисты кальция второго и третьего поколений. Препараты этого класса препятствуют поступлению ионов кальция в гладкомышечные клетки сосудистой стенки и кардиомиоциты, вследствие чего происходит снижение периферического сосудистого сопротивления и сердечного выброса.
Дигидропиридиновые антагонисты кальция (нифедипин, амлодипин, фелодипин, исрадипин, никардипин, нитрендипин, нисолдипин, лацидипин) предпочтительны для лечения больных с гипертрофией левого желудочка, признаками атеросклероза сонных и периферических артерий, пожилых пациентов с изолированной систолической АГ, могут применяться при беременности. Дигидропиридины вызывают выраженную вазодилатацию, но могут приводить к рефлекторной активации симпатической нервной системы. Этот эффект особенно выражен у препаратов короткого действия, тем не менее даже пролонгированные антагонисты кальция дигидропиридинового ряда целесообразно назначать больным с нормальной ЧСС или склонностью к брадикардии. У некоторых больных на фоне лечения дигидропиридиновыми антагонистами кальция возникают отеки голеней и стоп. Развитие тканевого отека связано с дилатацией артериол. Недигидропиридиновые антагонисты кальция (верапамил и дилтиазем) рекомендуется применять для лечения больных АГ в сочетании с ИБС и суправентрикулярными тахикардиями. Препараты этой группы не вызывают активации симпатической нервной системы, но обладают отрицательными хронотропным, дромотропным и инотропным эффектами, поэтому их не следует назначать больным с АВ-блокадой II – III степени и хронической СН.
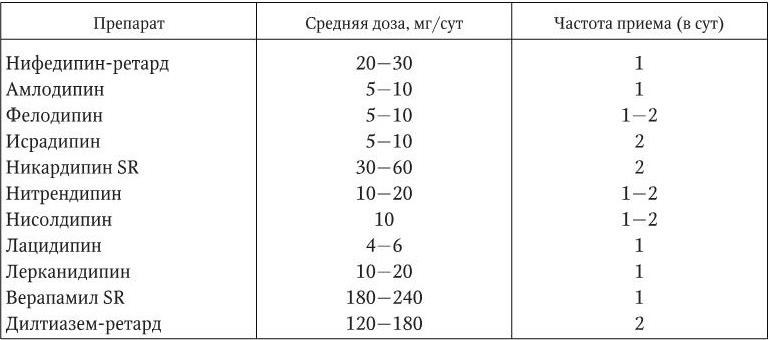
Средние дозы и кратность приема антагонистов кальция, наиболее широко применяемых в терапии АГ, указаны в табл. 1.16.
Таблица 1.16
Средние дозы и частота приема антагонистов кальция, наиболее широко применяемых для лечения больных АГ
Диуретики – неоднородный класс антигипертензивных препаратов. Мочегонные средства разделяются по месту воздействия на нефрон, выраженности диуретического и антигипертензивного эффектов, продолжительности действия, влиянию на метаболизм. В целом гипотензивный эффект диуретиков обусловлен их способностью тормозить реабсорбцию натрия, вследствие чего увеличивается диурез, уменьшается объем внеклеточной жидкости и циркулирующей плазмы. Индапамид за счет воздействия на гладкомышечные клетки сосудистой стенки обладает непосредственным вазодилататорным эффектом.
В терапии АГ чаще других препаратов данного класса применяются гидрохлоротиазид и индапамид-ретард. Эти препараты целесообразно применять при сочетании АГ с хронической СН, сопровождающейся застойным синдромом, и у больных с изолированной систолической АГ. Индапамид обладает способностью уменьшать выраженность гипертрофии левого желудочка. Средние дозы гидрохлоротиазида и индапамида-ретард составляют соответственно 12,5 – 25 и 1,5 мг однократно в сутки. Фуросемид применяется главным образом в терапии гипертонических кризов и острой СН, а также при выраженном застойном синдроме, калийсберегающие диуретики (триамтерен, спиронолактон) – в лечении больных с гипокалиемией и хронической СН.
Уменьшение объема внеклеточной жидкости, обусловленное приемом диуретиков, может приводить к развитию гипотензии и сопровождаться ощущением слабости. Применение тиазидных и петлевых диуретиков может вызывать электролитные расстройства, прежде всего гипокалиемию, которая проявляется нарушениями ритма сердца и судорогами. К числу нежелательных следствий длительной терапии тиазидными диуретиками относят метаболические нарушения: повышение риска развития сахарного диабета, проатерогенные сдвиги липидного спектра крови, гиперурикемию.
Гипотензивный эффект á-адреноблокаторов (фентоламин, празозин и др.) обусловлен блокадой вазоконстрикторного действия норадреналина. Клонидин, метилдофа, гуанфацин стимулируют á2-адренорецепторы в вазомоторном центре продолговатого мозга, что приводит к ослаблению центральной симпатической стимуляции. Моксонидин и рилменидин действуют как агонисты I1-имидазолиновых рецепторов центральной нервной системы, активация которых вызывается торможением высвобождения катехоламинов. Антигипертензивные препараты дополнительных классов редко применяются в режиме монотерапии. К их назначению прибегают в случаях недостаточной эффективности, противопоказаниях к применению или плохой переносимости препаратов основных классов.
Комбинированная терапия двумя и более антигипертензивными препаратами позволяет усилить лечебный эффект за счет воздействия на разные патогенетические механизмы АГ, уменьшить риск развития побочных эффектов в связи с взаимной нейтрализацией механизмов их развития и уменьшением доз препаратов, обеспечить более эффективную органопротекцию, уменьшить риск сердечно-сосудистых осложнений. К числу рациональных комбинаций антигипертензивных препаратов относятся:
1) ингибитор АПФ + диуретик;
2) блокатор рецепторов ангиотензина II + диуретик;
3) ингибитор АПФ + антагонист кальция;
4) блокатор рецепторов ангиотензина II + антагонист кальция;
5) дигидропиридиновый антагонист кальция + β-адреноблокатор;
6) антагонист кальция + диуретик;
7) β-адреноблокатор + диуретик;
8) β-адреноблокатор + á-адреноблокатор.
В лечении пациентов с высоким и очень высоким риском сосудистых осложнений все более широкое применение находят фиксированные комбинации антигипертензивных препаратов, содержащие в одной таблетке два лекарственных соединения с различным механизмом действия. Применение фиксированных комбинаций позволяет уменьшить количество принимаемых таблеток и повысить приверженность пациента назначенному лечению.
Лечение гипертонического криза. Лечение пациентов с осложненным гипертоническим кризом осуществляется в отделении (палате) интенсивной терапии. Лечебные мероприятия следует начинать как можно раньше после диагностики гипертонического криза, но снижать АД следует постепенно во избежание ухудшения кровоснабжения головного мозга, сердца и почек. За первые 1 – 2 ч рекомендуется снизить АД не более чем на 25 % от исходного уровня, а в течение последующих 2 – 6 ч добиться снижения систолического АД до 160 мм рт. ст., диастолического АД – до 100 мм рт. ст. У пациентов с такими жизнеугрожающими состояниями, как расслаивающая аневризма аорты и острая левожелудочковая недостаточность, темп снижения АД должен быть ускорен, а у больных с острым нарушением мозгового кровообращения, напротив, замедлен в связи с высоким риском усиления ишемии головного мозга. В 1 – 3-и сутки после развития ишемического инсульта активная антигипертензивная терапия рекомендуется при АД, превышающем 200/120 мм рт. ст. Лечение больных с осложненным гипертоническим кризом начинают с внутривенного введения антигипертензивных лекарственных средств (табл. 1.17). После стабилизации состояния больного переходят на прием препаратов внутрь.
Таблица 1.17
Антигипертензивные препараты, применяемые для парентерального (внутривенного) введения при лечении гипертонического криза

При неосложненном гипертоническом кризе возможно как внутривенное, так и пероральное либо сублингвальное применение антигипертензивных препаратов. Лечение начинают немедленно, рекомендуемая скорость снижения АД составляет 25 % от исходного за первые 2 ч с достижением целевого уровня АД в течение последующих 24 – 48 ч. Лечебные мероприятия (в зависимости от выраженности клинической симптоматики) могут проводиться в кардиологическом, терапевтическом отделениях стационара или амбулаторных условиях. Для купирования неосложненного гипертонического криза применяют препараты с относительно быстрым и кратковременным действием. Однако применение лекарственных средств, вызывающих резкое неконтролируемое снижение АД (нифедипина с быстрым высвобождением действущего вещества, гидралазина), считается потенциально опасным. При отсутствии двустороннего стеноза почечных артерий рекомендуется применение каптоприла внутрь или под язык по 25 мг каждые 30 – 40 мин до общей дозы 150 мг. Пациентам с водно-солевым вариантом гипертонического криза, особенно при наличии клинических признаков застойной СН, показано применение фуросемида в дозе 40 – 80 мг однократно. Абсолютным противопоказанием к применению диуретиков является подагра. Препаратом выбора для купирования нейровегетативного варианта гипертонического криза считается клонидин – 0,15 мг внутрь, затем по 0,075 мг каждые 30 мин до суммарной дозы 0,6 мг. Однако применение клонидина противопоказано при алкоголь-индуцированных гипертонических кризах, так как на фоне интоксикации это может усилить заторможенность больного и вызвать резкую брадикардию. В этих случаях целесообразно применять β-адреноблокаторы короткого действия (пропранолол, метопролола тартрат). При подозрении на феохромоцитому или использование кокаина для купирования гипертонического криза следует применять фентоламин (5 мг внутривенно, при необходимости с повторной инфузией той же дозы через 5 – 10 мин).
Для достижения желаемого результата лечения больного с гипертоническим кризом и обеспечения последующего контроля АД рекомендуется сочетанное применение двух, а при необходимости – трех антигипертензивных лекарственных препаратов.
Профилактика. Вторичная профилактика ГБ – длительный, многолетний процесс, включающий изменение образа жизни, применение лекарственных препаратов и контроль эффективности лечебных мероприятий. На этапе достижения целевого уровня АД оценку эффективности лечебных мероприятий, переносимости и безопасности фармакотерапии рекомендуется проводить с интервалом 3 – 4 нед. После стабилизации АД на целевом уровне контрольные осмотры врача пациентов с низким и средним риском сосудистых осложнений могут осуществляться один раз в 6 мес. Интервалы между врачебными осмотрами больных с высоким и очень высоким риском, а также пациентов с низкой приверженностью лечению не должны превышать 3 мес.
В связи с тем что ГБ – хроническое заболевание, антигипертензивная терапия должна проводиться постоянно. Отмена эффективной лекарственной терапии в большинстве случаев приводит к повышению АД. Лишь у пациентов с низким и средним риском возможно уменьшение доз и количества принимаемых препаратов при условии соблюдения мер по изменению образа жизни и стойкого снижения АД до целевого уровня.
Составляя программу вторичной профилактики ГБ у конкретного больного, врач должен учитывать не только специфику заболевания, но и целый ряд других индивидуальных характеристик пациента, включая его социально-экономический статус и психологические особенности. Процесс вторичной профилактики ГБ требует активного участия как врача, так и пациента. Важнейшим условием успешного предотвращения сердечно-сосудистых осложнений ГБ является повышение медицинской грамотности больного. Врач должен информировать пациента о факторах риска заболевания, характере возможных осложнений, пользе немедикаментозного и медикаментозного лечения, разъяснить механизмы действия назначенных ему лекарственных препаратов, обсудить основные аспекты эффективности и безопасности фармакотерапии, а также обучить больного пользоваться тонометром и дать рекомендации по возможному самостоятельному изменению доз препаратов в зависимости от результатов измерения АД. Формирование мотивации к лечению, превращение пациента из пассивного потребителя медицинских услуг в активного участника лечебного процесса способствует повышению приверженности больного рекомендациям врача и тем самым уменьшению вероятности неблагоприятного течения болезни.
1.4. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Определение. Ишемическая болезнь сердца (ИБС) – заболевание, в основе которого лежит несоответствие коронарного кровотока метаболическим потребностям сердечной мышцы.
Распространенность. ИБС относится к числу самых распространенных заболеваний и является одной из ведущих причин смерти населения экономически развитых стран. В Российской Федерации ИБС стойко занимает первое место в структуре смертности от болезней системы кровообращения – на долю этого заболевания приходится около половины смертей от сердечно-сосудистых причин. С учетом того что смертность от заболеваний системы кровообращения в течение последних 10 лет составляет около 55 % общей смертности населения, каждая четвертая смерть в нашей стране обусловлена ИБС.
Этиология. В большинстве случаев ИБС развивается вследствие атеросклероза коронарных артерий, поэтому факторы риска атеросклероза одновременно являются и этиологическими факторами ИБС. К числу основных факторов, способствующих развитию ИБС, относятся дислипидемия, АГ, курение и сахарный диабет. Важными немодифицируемыми факторами риска ИБС являются возраст, мужской пол и неблагоприятный семейный анамнез. Кроме того, вероятность развития ИБС связана с ожирением, гиподинамией, диетическими, социально-экономическими и другими модифицируемыми факторами риска.
Классификация. Общепринятой классификации ИБС до настоящего времени не существует. Для решения задач клинического характера используется рабочая классификация ИБС, приведенная ниже.
Рабочая классификация ИБС:
1. Внезапная сердечная смерть (первичная остановка сердца).
2. Стенокардия:
2.1. Стабильная стенокардия напряжения.
2.2. Нестабильная стенокардия:
2.2.1. Впервые возникшая стенокардия.
2.2.2. Прогрессирующая стенокардия.
2.2.3. Ранняя постинфарктная или послеоперационная стенокардия.
2.3. Спонтанная (вазоспастическая, вариантная, Принцметала) стенокардия.
3. Безболевая ишемия миокарда.
4. Микроваскулярная стенокардия («синдром Х»).
5. Инфаркт миокарда:
5.1. Инфаркт миокарда с зубцом Q (крупноочаговый, трансмуральный);
5.2. Инфаркт миокарда без зубца Q (мелкоочаговый, нетрансмуральный).
6. Постинфарктный кардиосклероз.
7. Сердечная недостаточность.
8. Нарушения сердечного ритма и проводимости.
Клинические проявления ИБС существенно различаются по симптоматике и прогнозу, что позволяет рассматривать их как самостоятельные заболевания. Наличие у пациента какого-либо одного из перечисленных клинических вариантов ИБС не исключает появления другого. Например, дебютируя ИМ, ИБС в течение многих последующих лет может проявляться только стенокардией напряжения. В других случаях отмечается медленное или быстрое прогрессирование заболевания в виде постепенного снижения толерантности к физической нагрузке с последующим развитием ИМ. В постинфарктном периоде нередко наблюдается значительное снижение функционального класса, а иногда и исчезновение стенокардии. Иногда ИБС проявляется не столько приступами ангинозных болей, сколько хронической СН и нарушениями ритма сердца. У некоторых больных первым и единственным проявлением ИБС становится внезапная смерть.
1.4.1. Стенокардия (грудная жаба)
Определение. Стенокардия – клиническое проявление транзиторной ишемии миокарда, которая развивается вследствие острого несоответствия между потребностью миокарда в кислороде и его доставкой.
Распространенность. В большинстве европейских стран распространенность стенокардии составляет 20 – 40 тыс. на 1 млн населения. Доля лиц, страдающих стенокардией, увеличивается с возрастом. В возрастной группе 45 – 54 лет стенокардия диагностируется у 2 – 5 % мужчин и 0,5 – 1 % женщин, в группе 65 – 74 лет – у 10 – 20 % мужчин и 10 – 15 % женщин, в группе старше 75 лет распространенность стенокардии составляет 25 – 33 % и не имеет половых различий.
Патогенез. Основными факторами, определяющими потребность сердечной мышцы в кислороде, являются напряжение миокарда, сократимость миокарда, ЧСС, пред- и постнагрузка. В связи с тем что перфузия коронарных артерий происходит во время диастолы, доставка кислорода к миокарду зависит не только от пропускной способности коронарных артерий, но и от уровня диастолического давления в аорте и продолжительности диастолы. В физиологических условиях соответствие снабжения миокарда кислородом его метаболическим потребностям достигается изменением сопротивления коронарных артерий. При неизменном перфузионном давлении за счет расширения венечных артерий объемная скорость коронарного кровотока может увеличиться в 4 – 5 раз по сравнению с его величиной в покое. Этот механизм позволяет избежать ишемии миокарда при физической и эмоциональной нагрузке.
Главной причиной несоответствия доставки кислорода метаболическим потребностям миокарда является атеросклероз коронарных артерий, морфологические признаки которого обнаруживаются у 90 % больных стенокардией. Уменьшение эластичности стенок и последующее сужение просвета коронарных артерий приводят к снижению коронарного резерва. Клинически значимым уровнем стенозирования считается уменьшение внутреннего диаметра коронарной артерии на 70 – 75 %. При такой степени сужения просвета артерии коронарный кровоток оказывается недостаточным для того, чтобы обеспечить метаболические потребности миокарда в условиях физической нагрузки или эмоционального стресса. К числу других возможных причин стенокардии относятся врожденные аномалии коронарных артерий, коронариит, выраженная анемия, а также состояния, связанные с увеличением потребности миокарда в кислороде до уровня, превышающего пропускную способность неизмененных коронарных артерий: гипертрофическая кардиомиопатия (КМП), АГ, гипертиреоз, аортальные пороки сердца, чрезмерное физическое напряжение и др.
Атеросклеротический процесс сопровождается развитием дисфункции эндотелия, которая проявляется нарушенной способностью коронарного русла к вазодилатации в ответ на сосудорасширяющие стимулы и повышенной адгезивностью эндотелиальной выстилки сосудов. У ряда больных ведущим механизмом уменьшения доставки кислорода к миокарду становится не органическое сужение коронарных артерий и ограничение их расширительного резерва, а вазоспазм или обратимое внутрисосудистое тромбообразование. Усиление реакции коронарной артерии на нейрогормональные сосудосуживающие стимулы и образование нестойких тромбоцитарных агрегатов отмечаются не только в местах выраженного атеросклеротического повреждения сосудистой стенки, но и в участках сосудов без видимых анатомических изменений, так как патофизиологической основой динамической коронарной обструкции является локальное повреждение и нарушение функции эндотелия. У большинства пациентов фиксированная и динамическая коронарная обструкция сочетаются. На разных этапах заболевания может преобладать тот или иной механизм коронарной недостаточности, что и определяет индивидуальные особенности ее клинических проявлений.